テクニカルインフォメーション
高分子量サンプルの分離 u-PAGEL H
高い物理的強度と分離能を備えた究極のゲル!
u-PAGEL H は、新規架橋剤の採用により従来のプレキャストゲルよりもポアサイズが大きく、かつ、強度の高いゲルです。従来のプレキャストゲルと比較して、泳動試料が目詰まりせずにゲル内に入るため、今まできれいに分離できなかった高分子バンド (200kDa≦) も高解像度に分離できます。u-PAGEL H は、新規架橋剤によりもたらされた効果として、優れた機械的強度を備えていることから、低濃度ゲルであっても染脱色操作、あるいは、ブロッティング操作において、ゲルがやぶれてしまうことが少なくなり、操作性が飛躍的に向上しました。さらに、新たに開発したゲル緩衝液の採用によって、従来よりも転写効率が向上しました。
u-PAGEL H
製品ラインナップ
u-PAGEL H 5%
分画分子量範囲:75~1,000kDa
u-PAGEL H 3-14%
分画分子量範囲:20~1,500kDa
u-PAGEL H 3-10%
分画分子量範囲:35~1,500kDa
u-PAGEL H 4-20%
分画分子量範囲:5~600kDa
泳動条件
※5%, 3-10%および3-14%ゲルにEzRun MOPSを使用すると、高分子タンパク質の分離範囲が狭まるため、推奨しておりません。
| 泳動緩衝液 | 泳動条件 | 泳動時間 | ||
|---|---|---|---|---|
| 5% | 3-10%/3-14% | 4-20% | ||
| EzRun(Tris/Gly/SDS) | 300V c.v. | 35~45分 | 35~45分 | 30~40分 |
| 150V c.v. | 90~110分 | 90~100分 | 70~80分 | |
| 20mA/gel c.c. | 100~120分 | 100~120分 | 75~85分 | |
| EzRun TG(Tris/Gly) | 20mA/gel c.c. | 90~100分 | 90~110分 | 65~85分 |
| EzRun MOP(Tris/MOPS/SDS) | 250V c.v. | ― | ― | 25~35分 |
| 150V c.v. | ― | ― | 55~65分 | |
| 20mA/gel c.c. | ― | ― | 75~85分 | |
仕様
| u-PAGEL H (5%) | u-PAGEL H (3-10%) | u-PAGEL H (3-14%) | u-PAGEL H (4-20%) | |||||
|---|---|---|---|---|---|---|---|---|
| ゲル濃度 | 5% 均一 | 3-10% グラディエント | 3-14% グラディエント | 4-20% グラディエント | ||||
| 製品名 | UH-T5 | UH-R5 | UH-T310 | UH-R310 | UH-T314 | UH-R314 | UH-T420 | UH-R420 |
| コードNo. | 2331300 | 2331310 | 2331302 | 2331312 | 2331306 | 2331316 | 2331304 | 2331314 |
| 検体数 | 14 | 18 | 14 | 18 | 14 | 18 | 14 | 18 |
| 最大アプライ量 | 14検体:最大24uL/well 18検体:最大18uL/well | |||||||
| ゲルサイズ | 90mm (W) × 83mm (H) × 1mm (D) | |||||||
| 入数 | 10枚/箱 | |||||||
| 保存温度・使用期限 | 冷蔵・1年間 | |||||||
| 価格 | 価格は製品情報ページでご確認ください | |||||||
ゲルの強度
新規架橋剤により、ゲルの強度がパワーアップ!
ポリアクリルアミドゲル は、アクリルアミドと架橋剤である N,N'- メチレンビスアクリルアミド(Bis) がラジカル重合により結合した重合体です。アクリルアミドだけでは直鎖状につながっていくだけですが、架橋剤を加えることにより、架橋の役割を果たして網目(三次元)構造を持った重合体(ゲル)ができます。ゲル濃度が低いほどポアサイズが大きくなるため、高分子タンパク質の分離が可能になります。しかし Bis は溶解度が低いため、Bis 同士が集まる部分ができ、不均一なゲルとなります。不均一なゲルは機械的強度が下がり、もろくやぶれやすいために取り扱いが難しいことが課題でした。
今回アトーは Bis よりも溶解性が高く、結合の手の長い新規架橋剤を用いることで、低濃度であっても、均一なゲルの開発に成功しました(下図および動画)。
Bis の 約1.7倍高い引張破断応力で、機械的強度が優れています。またポアサイズが大きくなることで、泳動試料がゲルの網目に目詰まりすることなくスムーズに入り、さらに高い分離能を示します。
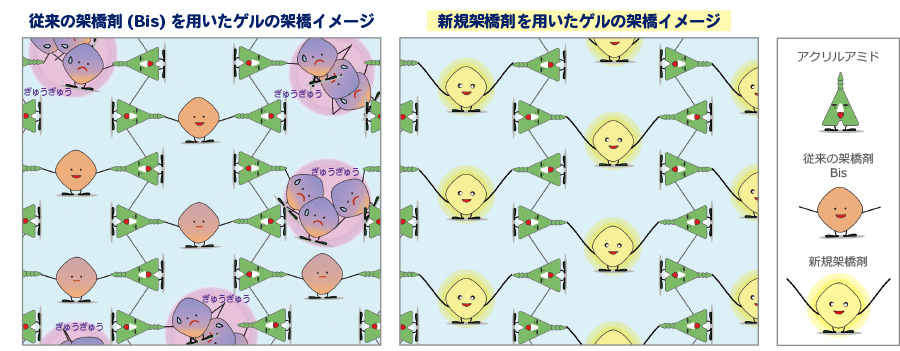
こんなに引っ張ってもやぶれません!
新規架橋剤を用いたゲルは、Bis を用いたゲルに比べて、引張破断ひずみが 約1.7倍高く、やぶれにくいことが特長です。染脱色操作やブロッティング操作において、ゲルの取扱いが格段にしやすくなりました。(※強度を説明するためにゲルを引っ張っています。操作時には丁寧に扱ってください。)

電気泳動データ例
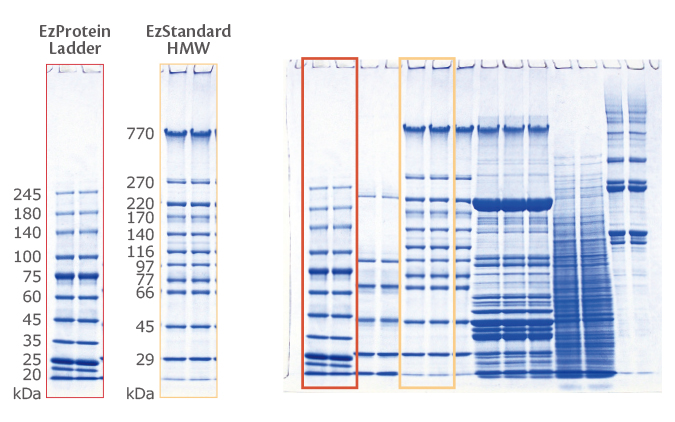
データ例1:高分子領域の分画範囲が広いのが特長です
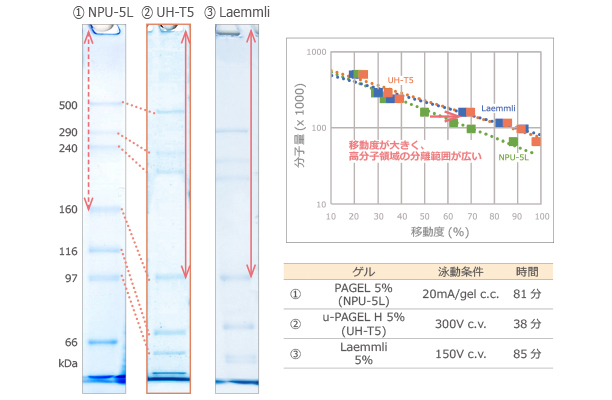
上図は、高分子量マーカーを 5% の u-PAGEL H (UH-T5) と従来品の PAGEL (NPU-5L)、Laemmli法に準拠したゲルで泳動した結果および画像解析ソフトCS Analyzer 4で解析した検量線を示しています。
検量線から u-PAGEL H はPAGELよりも移動度が大きく、u-PAGEL H (②) と PAGEL (①) の矢印の長さの違いから、高分子領域の分離範囲が広いことが確認できます。
u-PAGEL H は、Laemmli法に準拠したゲルと同等の移動度および高分子量分離範囲を示します。
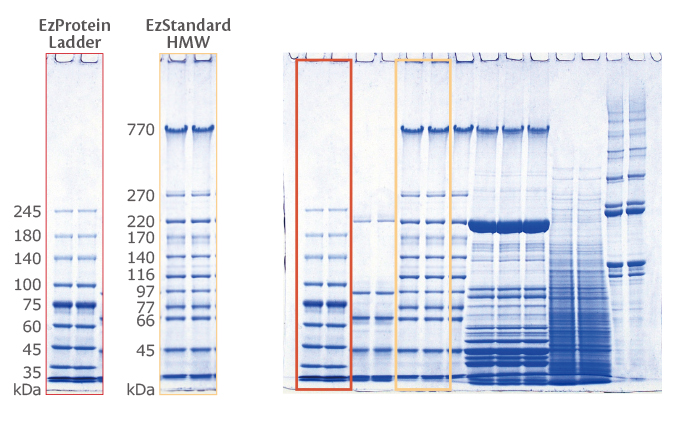
データ例2:高分子バンドがこんなにシャープです
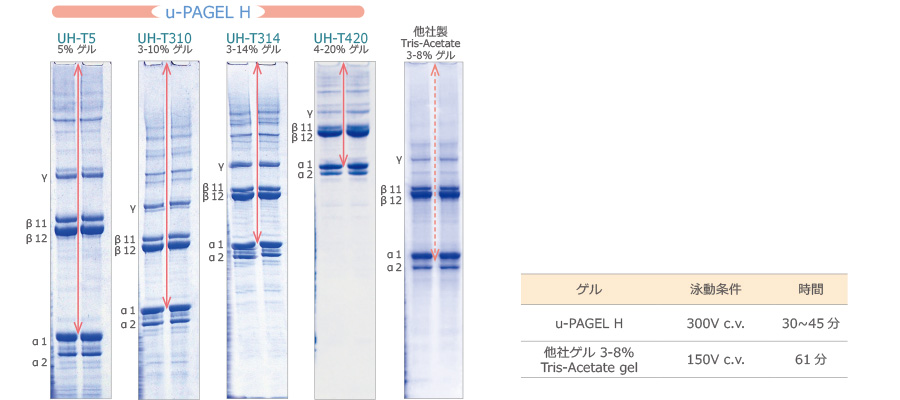
上図は、各種u-PAGEL H と他社のゲルを用いてSDS-PAGEによりCollagen (コラーゲン)抽出液を泳動した結果を示しています。
u-PAGEL H は、他社ゲルに比べてバンドがスメアにならず、高分子のバンドもシャープに分離されることが確認できます。
特にβ11と β12がシャープに分離されており、γ のバンドも明瞭に確認できるうえ、さらに高分子領域のバンドもはっきりと視認できます。
さらにu-PAGEL Hは、他社ゲルの約半分の時間で高速泳動が終了するうえに、低分子から高分子に至るまで、バンドがシャープに分離できることがわかります。
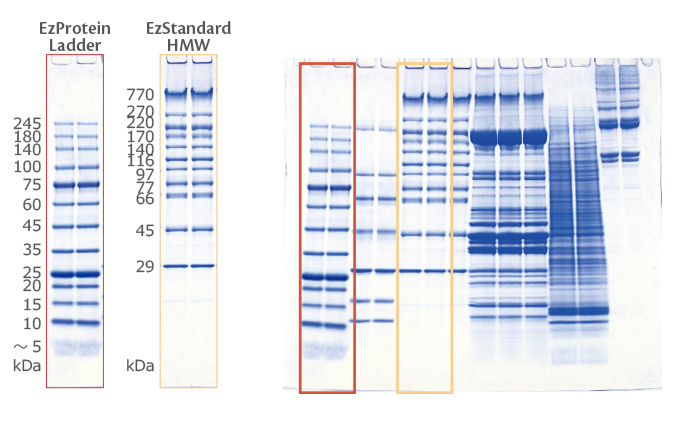
データ例3:u-PAGEL H 4-20%で低分子領域の分離もばっちりです
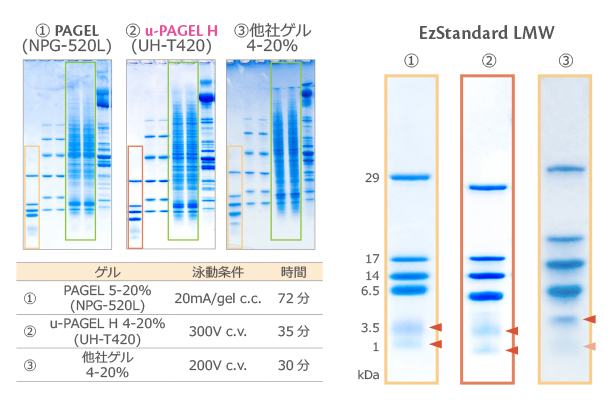
上図は、4-20% の u-PAGEL H (UH-T420) と従来品の 5-20% の PAGEL (NPG-520L)、他社既製ゲルを泳動して比較した結果を示しています。
さらにゲル内の橙色枠で囲んだ低分子用分子量マーカーEzStandard LMW のレーンを拡大して示しています。
他社ゲル (③) は 1kDa のバンドがスメアで不明瞭なのに対して、u-PAGEL H (②) は、1kDa まで明瞭に分離できることが示されました。
さらに従来品の約半分の時間で高速泳動をしても、緑色で囲まれた HeLa抽出液が明瞭なバンドに分離されており、他社ゲル (③) よりも良好なパターンが得られることがわかります。
データ例4:1年間保存したゲルでも安定したデータが得られます
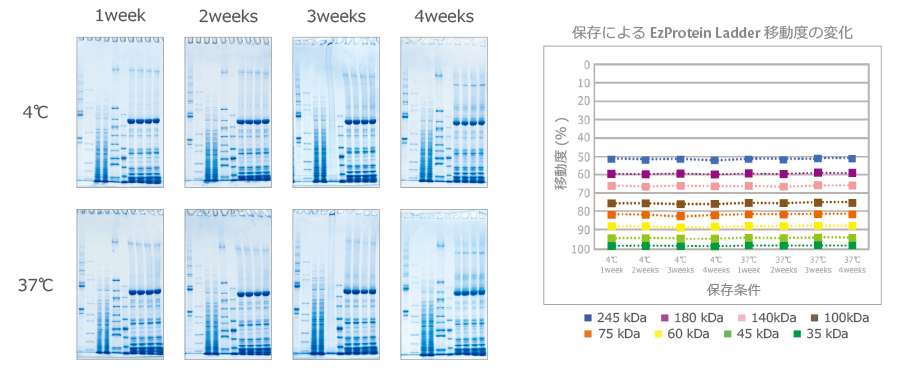
上図は、3-10% の u-PAGEL H (UH-R310) の保存安定性試験のデータです。
ポリアクリルアミドゲルの場合、おおよその目安ですが、37℃で1日の加温処理は4℃保存時の 約1か月に相当するといわれています。
u-PAGEL H (UH-R310) の泳動パターンからは、37℃で4週間の加温処理後も、シャープなバンドが分離できることが確認できました。
また有色分子量マーカー EzProtein Ladder の移動度が、保存期間によって変化することなく、長期保存しても良好な泳動パターンが得られることが確認できます。
したがって、u-PAGEL Hは4℃保存で少なくとも1年間は品質が安定であるといえます。
アプリケーションデータ
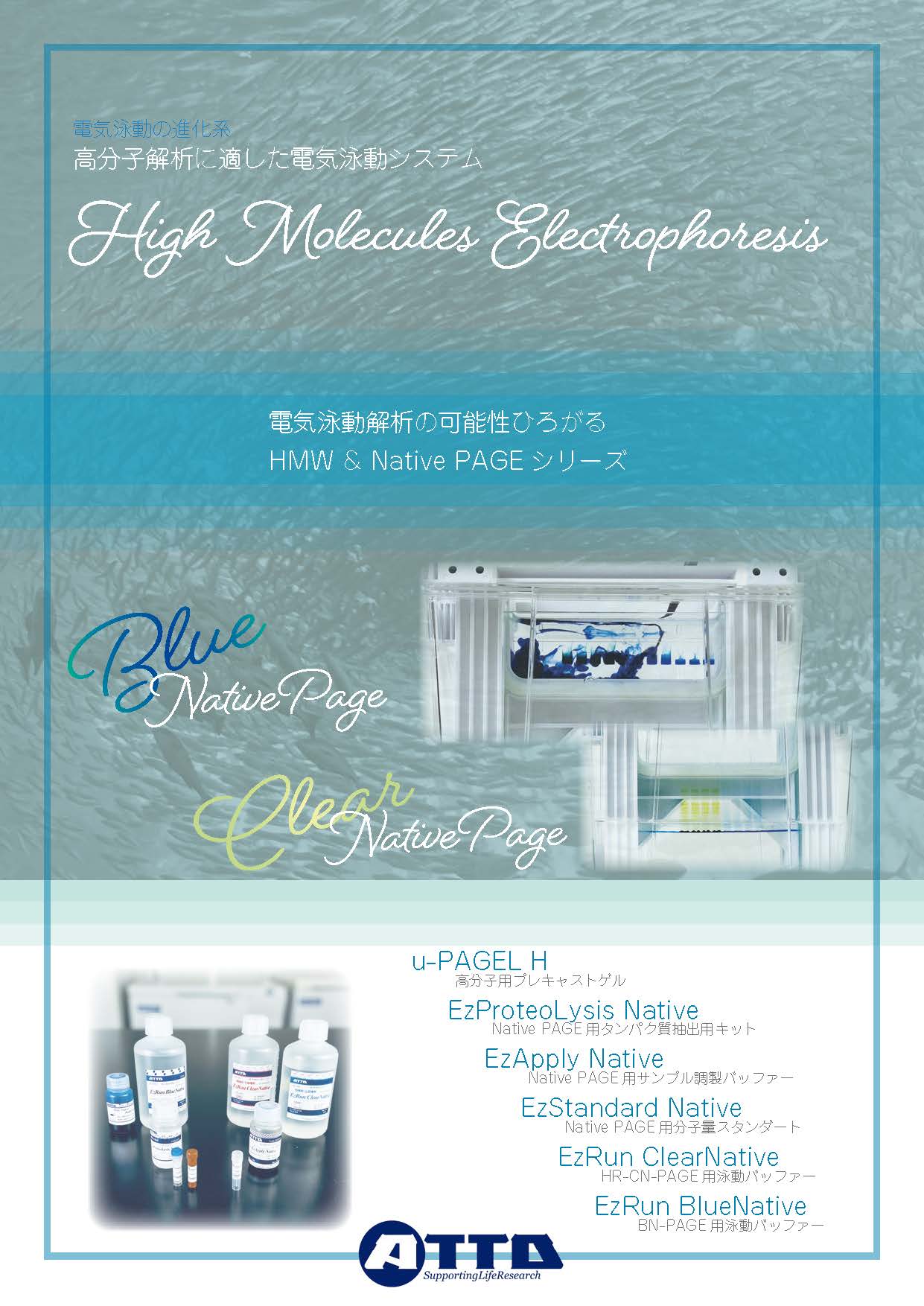
データ例5:Tris-Glycine系ゲルを使用したBlue-Native PAGEおよびHigh-Resolution-Clear-Native PAGE
Native PAGEはドデシル硫酸ナトリウム(SDS)や還元剤(DTT など)を使用せずに、タンパク質をポリアクリルアミドゲルで電気泳動により分離する手法です。
Native PAGE には従来の Native PAGE のほかに、弱い陰イオン性界面活性剤を利用した High-Resolution-Clear Native PAGE(HR-CN-PAGE)やタンパク質の高次構造を壊さずに、負電荷を帯びた色素であるクーマジーブリリアントブルー(CBB)を利用した Blue-Native PAGE(BN-PAGE)があります。
これらの方法は元々Bis-Tris系ゲルがベースとなって開発された泳動法であり、Tris-Glycine系ゲルには適さない方法でした。
アトーでは、これまで出来ないとされてきたTris-Glycine 系ポリアクリルアミドゲルで HR-CN-PAGEと BN-PAGEができる画期的な泳動用バッファーEzRun ClearNativeとEzRun BlueNativeを取り揃えております。
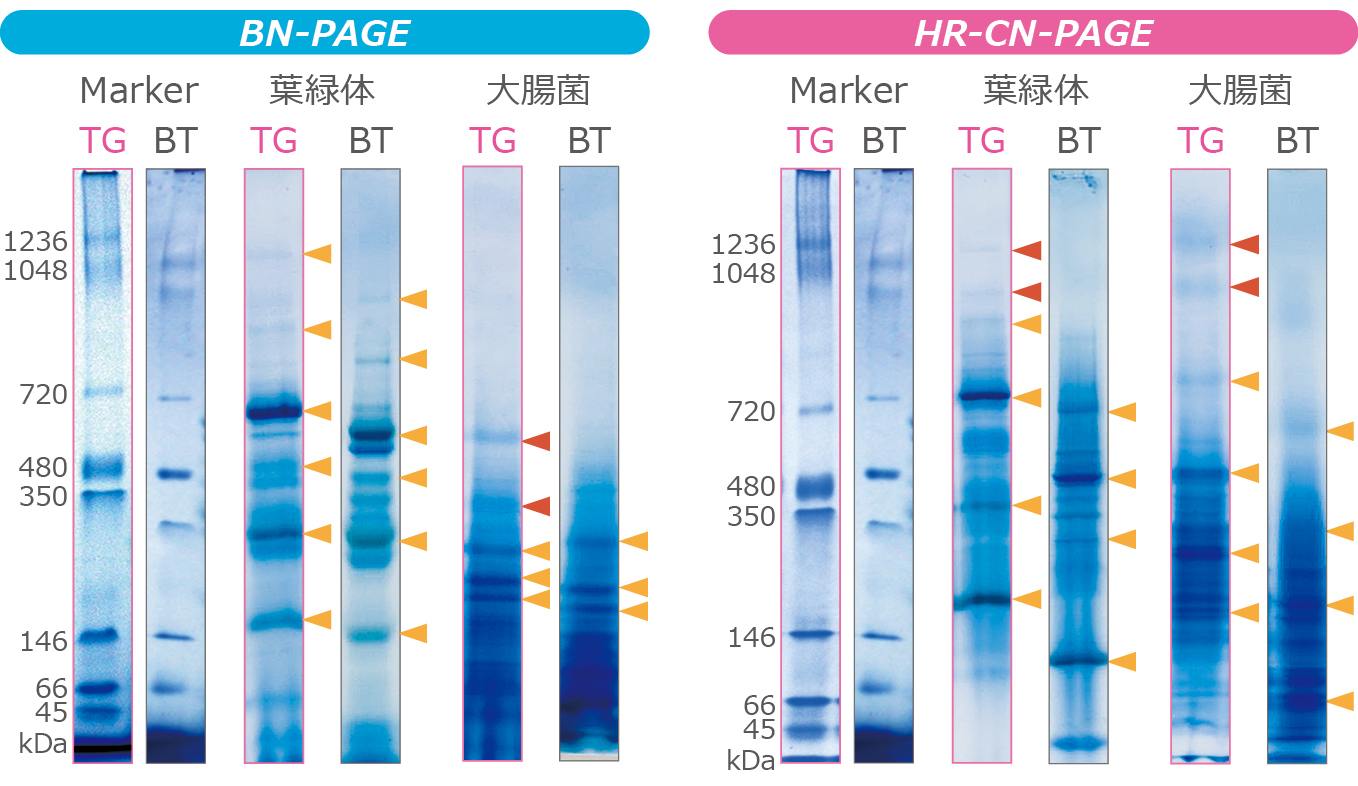
上図は、分子量スタンダードEzStandard Native、葉緑体抽出液、大腸菌抽出液をTris-Glycine系ゲルであるu-PAGEL H(TG)と従来法であるBis-Tris系ゲル(BT)を使用して、 HR-CN-PAGEと BN-PAGEにより泳動分離した結果を示しています。
黄矢印は相対するバンドを示しており、赤矢印はu-PAGEL Hでのみ分離できた高分子を示しています。
いずれの結果からもu-PAGEL H(TG)とBis-Tris系ゲル(BT)のBN-PAGEあるいはHR-CN-PAGEで高い相関性が得られることが確認できます。さらにu-PAGEL Hを使用したBN-PAGEやHR-CN-PAGEは、赤矢印で示したようなスーパーコンプレックスの分離にも適しています。
データ例6:タンパク質の酵素活性染色
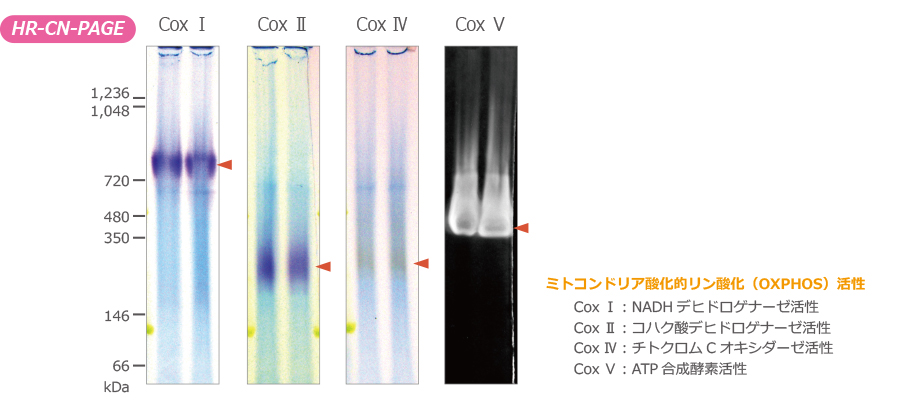
上図はu-PAGEL H (UH-T314)でニワトリ肝ミトコンドリアタンパク質をHR-CN-PAGEにより泳動分離し、NADHデヒドロゲナーゼ(CoxⅠ)、コハク酸デヒドロゲナーゼ(CoxⅡ)、チトクロムCオキシダーゼ(CoxⅣ)、ATP合成酵素(CoxⅤ)をゲル内での酵素活性染色により検出した結果を示しています。
活性染色後のゲルは、Printgraph Classicでカラー撮影しました。
HR-CN-PAGEは、無色透明のゲルのままで、タンパク質の酵素活性を保持しながら泳動分離することができるので、泳動後の酵素活性染色ではクリアなバンドを検出することができます。
データ例7:ゲル染色フリーでトータルタンパク質のノーマライズ

上図は、EzLabel FluoroNeoで蛍光標識した細胞抽出液をu-PAGEL H (UH-R310) で分離し、ウェスタンブロッティングを行った結果を示しています。
EzLabel FluoroNeoで蛍光標識したバンドを、Blue LEDで励起して検出・撮影し、EzFastBlot HMWで転写した後のPVDF膜とゲルを蛍光検出しました。
転写後のゲルにはバンドがほとんど確認できず、良好に転写できていることが確認できます。
さらに転写後のSMAD2抗体で抗原抗体反応を行い、EzWestLumiOneによりターゲットタンパク質を発光検出しました。
その後、トータルタンパク質とSMAD2シグナルの輝度値をCS Analyzer 4で解析し、トータルタンパク質でノーマライズを行った結果をグラフに示しました。
グラフに示されたように、ノーマライズ前後でターゲットタンパク質の相対シグナル値が変化する場合があり、より正確に解析する上でもノーマライズが重要なことが判ります。
データ例8:EzLabel FluoroNeoによる検出
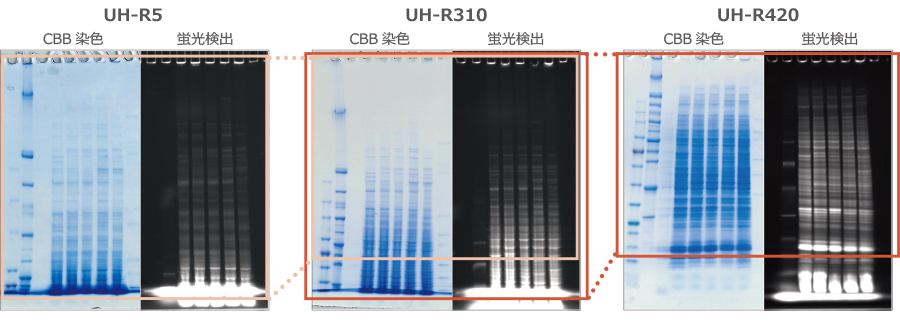
EzLabel FluoroNeo により蛍光標識した細胞抽出液を u-PAGEL H (UH-R310) で分離し、EzFastBlot HMW により転写して、ウェスタンブロッティングを行った結果を示しています。
上図は泳動後に EzStainAQua で染色したゲル(左)と EzLabel FluoroNeo で蛍光検出したゲル(右)を比較しました。どちらの手法でも感度良くバンドが検出されることが確認できます。
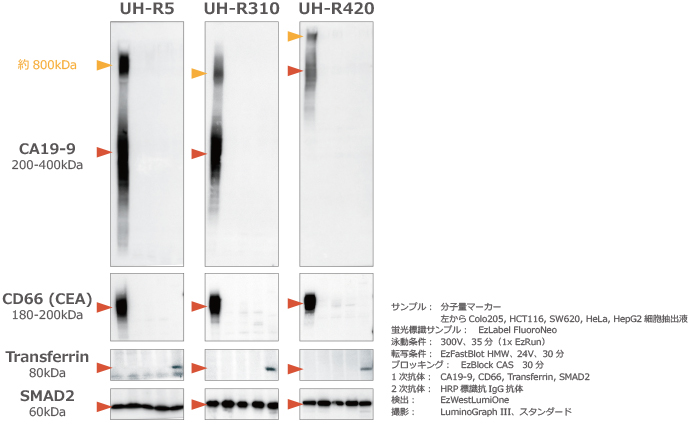
さらに泳動後のゲルをウェスタンブロッティングした結果をゲルの下側に示しました。
CA19-9、CD66 の発現は大腸がん細胞由来の Colo205 細胞抽出液のみで、Transferrin の発現は肝がん細胞由来の HepG2細胞抽出液のみで確認されました。
一方、SMAD2 はすべての細胞株で発現していることが確認できました。
また CA19-9 のシグナルは、約200-400kDaのバンドとは別に、さらに高分子の 約800kDaの高分子バンドも良好に検出されることが示されました。
このように u-PAGEL H は蛍光検出にも適しており、500kDa 以上の高分子タンパク質を良好に分離し、ウェスタンブロッティングで効率よく転写してバンドを検出することができます。
データ例9:DNAの電気泳動
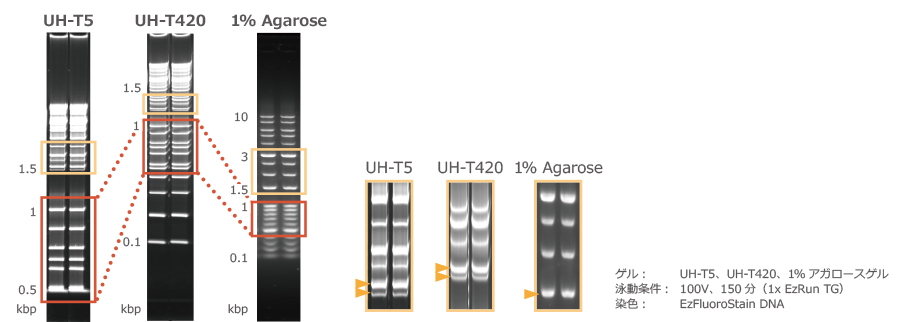
上図は、u-PAGEL H(UH-T5およびUH-T420)でDNAの電気泳動を行った結果と、比較として1% アガロースゲルで電気泳動した結果を示しました。
u-PAGEL HはDNAの分離にも適しており、とくに橙線枠で示した1kbp以下のバンドが、アガロースゲルよりも明瞭に分離できることが確認できます。
さらに黄線枠で示した1.5kbp以上の範囲では、1.5kbpのバンドはアガロースゲルでは1本に分離されていますが、u-PAGEL Hを使用すると2本の明瞭なバンドに分離できることが確認できます。
データ例10:タンパク質の活性検出

上図は、β-Galactosidase の活性染色をした結果を示しています。3-10% の u-PAGEL H (UH-T310) で Native-PAGE により分離しました。
電極液は EzRun TG を使用し、20mA の定電流で泳動しました。泳動終了後、発色基質 (X-gal) による活性染色および EzStain AQua で検出しました。

4-20% の u-PAGEL H (UH-T420) で Native-PAGE により分離した後、GFP の蛍光検出をした結果を示しました。
泳動後のゲルはガラスプレートから取り出さずに BlueLED で励起し、535nm バンドパスフィルターで検出、Luminograph Ⅲ(WSE-6300) で撮影しました。
蛍光検出後のゲルを銀染色した結果を下側に示しています。
PAGELシリーズ

PAGELⓇ シリーズの製品ラインナップ
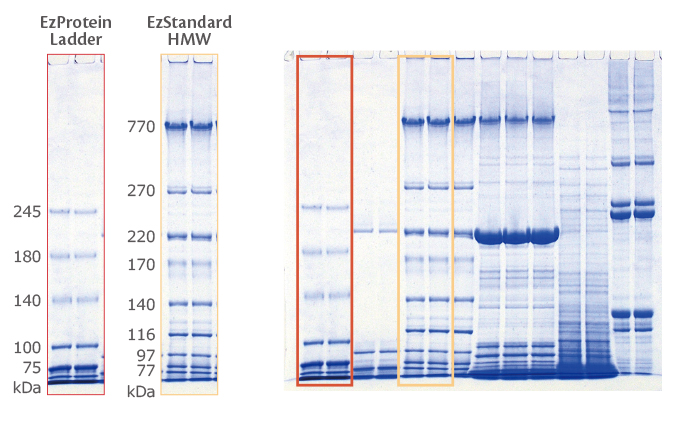
高分子タンパク質や低分子タンパク質に特化した最新のゲルや、グラディエントゲルなど、幅広いラインナップをご用意しております。さまざまな濃度に対応しており、使い勝手の優れたミニサイズ、サンプルやバッファーの節約にもオススメのコンパクトサイズ、多検体処理にオススメのワイドサイズより、ゲルサイズをお選びいただけます。
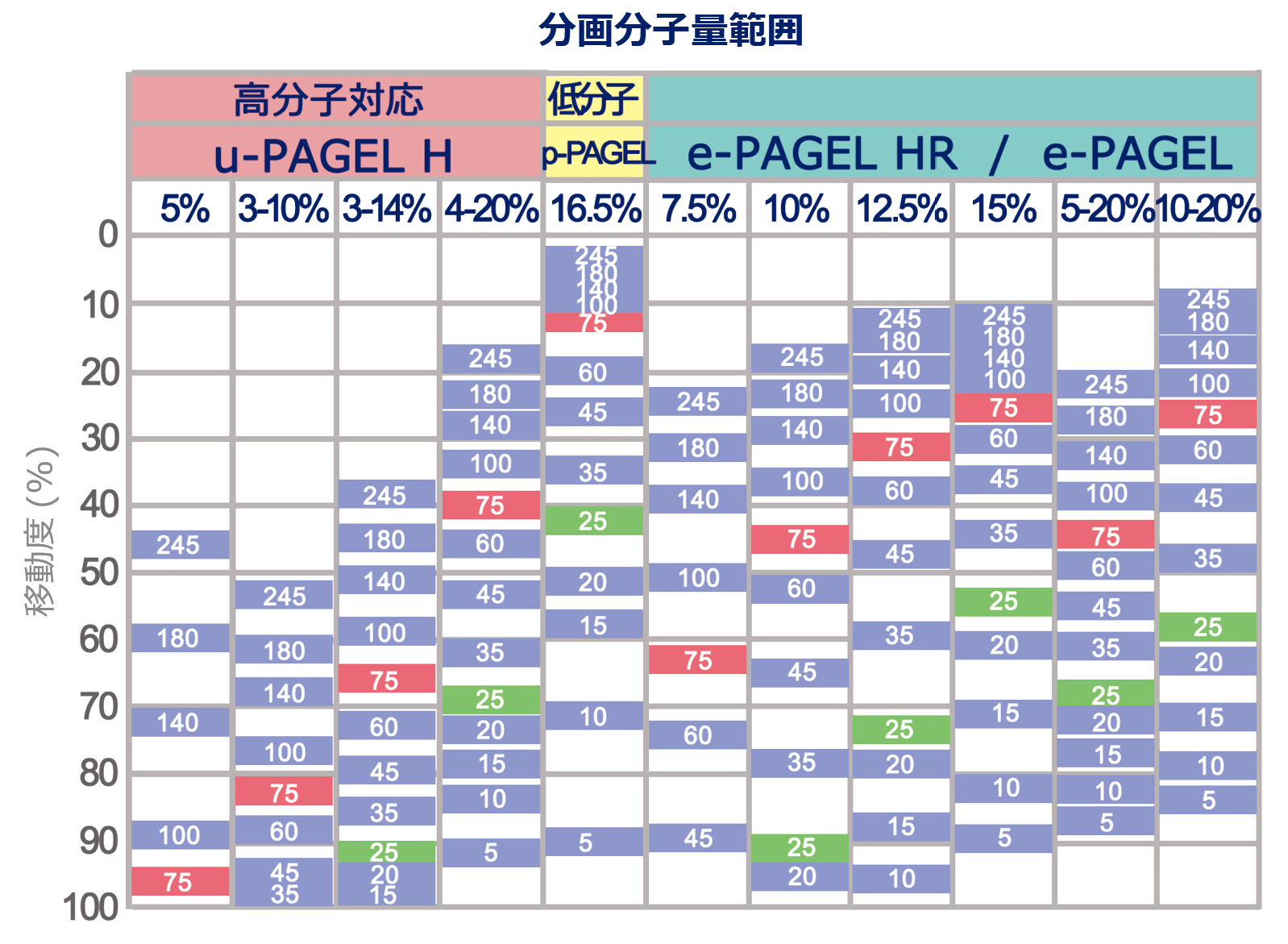
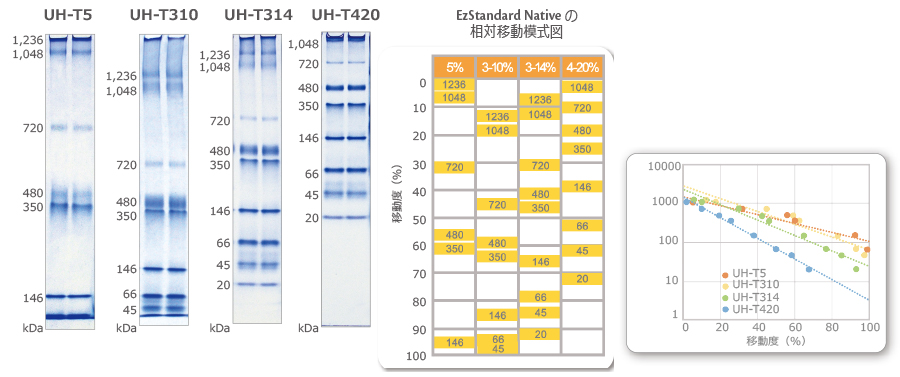
※上図は、有色分子量マーカーEzProtein Ladder を電気泳動にて分離した際の、移動度の模式図です。それぞれの数値は、各バンドのkDaを示しています。
分子量スタンダード
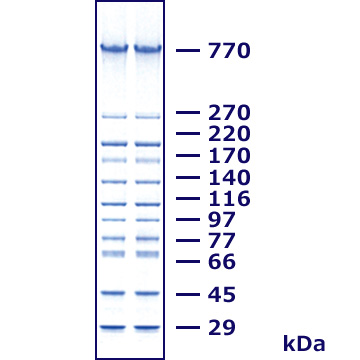
SDS-PAGE用高分子対応分子量スタンダード EzStandard HMW
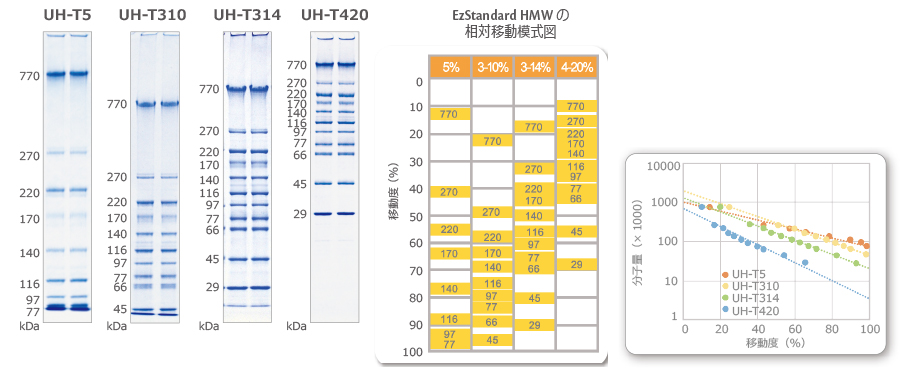
EzStandard HMWは、770~29kDa/11本のバンドの高分子量タンパク質マーカーです。
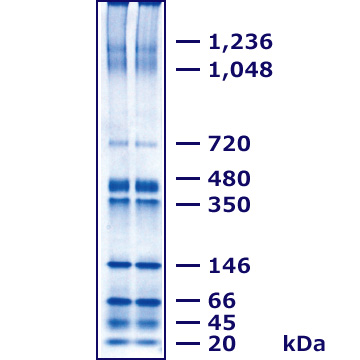
Native PAGE用分子量スタンダード EzStandard Native
資料ダウンロード
動画で紹介
u-PAGEL Hのセミドライブロッティングのコツ
Native PAGE
サンプル提供
サンプル品のご依頼は下記ボタンのサンプル依頼フォームからどうぞ