テクニカルインフォメーション
ポリアクリルアミドゲル電気泳動(PAGE)とは
ポリアクリルアミドゲル電気泳動(スラブ電気泳動)とは
スラブ電気泳動とは、一般にガラスなどのプレート間に作製したゲルを垂直に立てて電気泳動する方式を言います。主に核酸(DNA/RNA)やタンパク質のポリアクリルアミドゲルの電気泳動(Polyacrylamide Gel Electrophoresis=PAGE)に用いられ、電気泳動の中でも高い分離能を有する方法として広く用いられています。
緩衝液などに溶解した核酸(DNA/RNA)やタンパク質をポリアクリルアミドゲルに添加し、緩衝液中で一定時間電気泳動すると、サイズや分子量、荷電、立体構造などに応じた移動度を示し、結果として各々を分離することが出来ます。核酸は緩衝液中でー(マイナス)に荷電している為、直流電場では陽極に引かれて移動し、その際ゲルの分子ふるい効果により、核酸の分子量に応じた移動度を示します。
タンパク質やペプチドは構成アミノ酸や溶けている緩衝液のpHによって+(プラス)にも-(マイナス)にも荷電する為、SDS*1という陰イオン性界面活性剤をタンパク質に結合させ、タンパク質を一過性に-(マイナス)に荷電させ陽極側に移動させる手法がとられます。これをSDS-PAGE*2と言いスラブ電気泳動の代表的な手法になっています。この時タンパク質はゲルの分子ふるい効果で分子量に応じて分離することが可能となります。また、SDSを添加せず、タンパク質やペプチド固有の荷電などで泳動・分離する方法もあります(native-PAGE)。
*1 SDS:ドデシル硫酸ナトリウム(陰イオン性界面活性剤)
*2 PAGE:ポリアクリルアミドゲル電気泳動
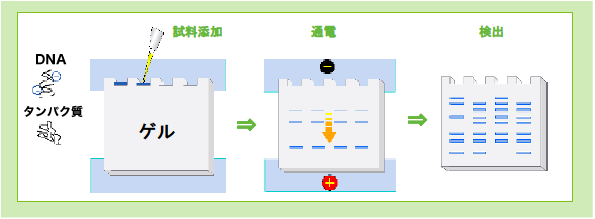
電気泳動後の検出は試料を染色する手法が一般的です。スラブ電気泳動で分離した核酸(DNA/RNA)やタンパク質は透明で、そのままではバンドを確認することができません。そのため、分離された成分の移動度や泳動パターンの確認にはバンドの検出が必要になります。 検出方法には電気泳動前に試料(核酸やタンパク質)に標識(RI、蛍光など)をしておき、泳動・分離後それを検出する方法や、電気泳動終了後、エチジウムブロマイド(EtBr:DNA/RNAの検出)やクマシーブリリアントブルー(CBB:タンパク質の検出)などの色素染色で可視化する方法などがあります。また、ブロッティングと組み合わせることで、ゲルから膜(メンブレン)に移した成分のうち、特定の核酸やタンパク質を高感度に検出する方法もあります。こうして得られた電気泳動パターンから、試料成分の比較、分子量の推定(分子量マーカー必要)や塩基特異性・変異の検出(多型)、精製度・純度の確認、遺伝子発現産物(RNA、タンパク質)の発現量比較などの情報を得ることが可能です。
電気泳動後のバンド検出法
| 染色方法(製品名) | 染色対象 | 検出方法 |
|---|---|---|
| エチジウムブロマイド(EtBr)染色 | 核酸 | 紫外線励起、蛍光検出 |
| 蛍光染色(WSE-7130 EzFluoroStain DNA) 蛍光染色(WSE-7135 EzPreStain DNA&RNA) |
核酸 | 青色LED、紫外線励起、蛍光検出 |
| SYPRO Ruby/Orange染色 | タンパク質 | 紫外線励起、蛍光検出 |
| 蛍光標識(WSE-7010 EzLabel FluoroNeo) | タンパク質(標識) | 青色LED、紫外線励起、蛍光検出 |
| クマシーブリリアントブルー(CBB)染色(AE-1340 EzStain AQua) | タンパク質 | 白色透過光 |
| 銀染色(AE-1360 EzStain Silver) | 核酸/タンパク質 | 白色透過光 |
| リバース染色(AE-1310 EzStain Reverse) | タンパク質(SDS) | 黒色シート上、反射光 |
関連製品
泳動槽の選択基準
スラブ型電気泳動装置は目的やサンプルにあわせてゲルサイズ、サンプルコウム(検体数)などからご選択ください。
さらに冷却や恒温化が必要な場合は温度コントロール可能な仕様の装置をご選択ください。
- 検体(試料)数が少ない、時間や試薬の節約をしたい方には、小さな6×6cmゲルのコンパクトPAGEシリーズをお勧めします。最短泳動時間10分です。
- 初めて電気泳動を行う方には、標準的なゲルサイズが8×9cmのミニスラブシリーズをお勧めします。泳動槽や検体数も多くのバリエーションがあります。
- 多くの検体(試料)を一度に泳動したい方には、マルチレーンゲルシリーズをお勧めします。ゲル2枚で最大60検体の泳動が可能です。
- 大きなサイズのゲルをご希望の場合は、ラピダス・スラブ電気泳動槽(約13cm四方のゲル)をご利用ください。
コンパクト(6×6cm)サイズ
| 型式 | WSE-1030 | WSE-1040 |
|---|---|---|
| 名称 | ||
| 適応 | 核酸、タンパク質、ポリペプチド等 | |
| ゲルサイズ | 60mm(W)×60mm(L) 0.75 / 1.0mm厚 | |
| ガラスプレートサイズ | 76mm(W)×70mm(L) | |
| バッファー量 | 245mL (下部槽135mL 上部槽110mL)/ゲル1枚あたり | |
| 同時泳動 ゲル枚数 | 1枚 | 最大2枚 |
| サンプルコウム (標準検体数) |
スマイリングレスコウム12検体 (ウェル幅2.9mm 最大アプライ量約8μL) |
|
| 泳動用電源 |
専用電源搭載型 プログラム済みモード(下記)を選択 |
|
| 既製ゲル | ||
ミニ(9×8cm)サイズ
| 型式 | WSE-1150 | AE-6530 | WSE-1165 |
|---|---|---|---|
| 名称 | |||
| 適応 | 核酸、タンパク質、ポリペプチド 等 | ||
| ゲルサイズ | 90mm(W)×80~83mm(L) 1mm厚 | ||
| ガラスプレートサイズ | 120mm(W)×102mm(L) | 100~120mm(W)×102mm(L) | |
| バッファー量 | 上部80mL 下部420mL | トータル 400~650mL | |
| ゲル恒温方式 | 上下バッファーによる両面恒温、高速ハイレゾ電気泳動対応 | ||
| 同時泳動 ゲル枚数 | 最大2枚 | ||
| サンプルコウム (標準検体数) | スマイリングレスコウム12検体 (ゲル自作仕様) ウェル幅4.5mm 最大アプライ量約28μL | ||
| 泳動用電源 | 搭載型(Low/Standard/High モード) | 別途用意 | |
| 既製ゲル | p-PAGELe-PAGEL HR e-PAGEL u-PAGEL H | ||
ワイド(14×8cm、13.8×13cm)サイズ
| 型式 | WSE-1170 | AE-6220 |
|---|---|---|
| 名称 | ||
| 適応 | 核酸、タンパク質、ポリペプチド 等 | |
| ゲルサイズ | 140mm(W)×80mm(L) 1mm厚 | 138mm(W)×130mm(L) 1mm厚 |
| ガラスプレートサイズ | 160mm(W)×100mm(L) | 160mm(W)×160mm(L) |
| バッファー量 | 最大900mL | 最大930mL |
| ゲル恒温方式 | 上下バッファーによる両面恒温、高速ハイレゾ電気泳動対応 | 上部バッファーによる片面恒温 |
| 同時泳動ゲル枚数 | 最大2枚 | 最大2枚 |
| サンプルコウム(標準検体数) | スマイリングレスコウム 30検体(ウェル幅3mm、最大アプライ量20μL) |
スマイリングレスコウム 12検体(ウェル幅6mm、最大アプライ量60μL) |
| 泳動用電源 | 別途用意 | 別途用意 |
| 既製ゲル | m-PAGEL | なし |
電源装置の選択基準
スラブ電気泳動装置をご使用になるには電気泳動用の電源装置が必要となります。装置(ゲル)サイズが大きくなるに従って必要な電圧容量が大きくなりますのでご考慮ください。
また、大まかにはポリアクリルアミドゲル電気泳動は電圧(V)重視、アガロース電気泳動やブロッティングは電流(A)重視の設定になりますのでその旨仕様を確認ください。
〇:適用 △:条件によって適用 ×:不適用
| 型式 | WSE-3100 | WSE-3200 | WSE-3500 | AE-8135 | AE-8155 | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| 名称 | ||||||||||
| コンパクトスラブ/ミニスラブ | 〇 | 〇 | △ | 〇 | 〇 | |||||
| スラブ | 〇 | 〇 | × | 〇 | 〇 | |||||
| 冷却スラブ | 〇 | 〇 | × | × | △ | |||||
| シークエンス | × | △ | × | × | × | |||||
| 等電点ディスク電気泳動 | 〇 | 〇 | × | △ | △ | |||||
| 等電点平板 電気泳動 | △ | △ | × | × | × | |||||
| サブマリン型 アガロース | 〇 | 〇 | △ | 〇 | △ | |||||
| セミドライブロッティング | 〇 | △ | 〇 | 〇 | △ | |||||
| 高速セミドライブロッティング | 〇 | △ | 〇 | △ | × | |||||
| ウエット(タンク式)ブロッティング | 〇 | × | 〇 | × | × | |||||