テクニカルインフォメーション
組織・細胞からのタンパク質抽出方法
「Protein」の語源はギリシャ語の「Proteios (一番重要なもの)」に由来するそうです。たしかにタンパク質は生体の構造や機能を担うのに不可欠な存在だといえます。タンパク質の機能を調べるためには、まず生体サンプルからタンパク質を抽出して可溶化することが重要です。今回は、アトーの製品を使用したタンパク質抽出方法に関してご紹介します。
タンパク質を抽出する際の一般的な注意点としては、以下のことが挙げられます。
1.サンプルの選択(新鮮で目的の事象がとらえやすいサンプルを選択)
2.温度(一般的には0~4℃)
3.pH、イオン強度(一般的にはpH 4~7、イオン強度は0.1 M)
4.チオール基(酸化を保護するためのDTT等の還元剤の添加)
5.安定化剤の添加(糖やグリセリン等の添加)
6.プロテアーゼインヒビターの添加
7.金属イオンのキレート
大腸菌からのタンパク質抽出方法
大腸菌などの微生物には細胞壁があるため、哺乳類の細胞に比べて破壊するのが困難です。一般的には超音波破砕、凍結融解による破砕、リソソームなどの酵素による溶解などによりタンパク質を抽出します。しかし、超音波や凍結融解による物理的破砕は、操作が煩雑な上に、しばしばタンパク質が壊れる原因になります。アトーのEzBactYeast Crusherは菌体に混ぜるだけでタンパク質を安定に抽出可能です。
実験方法
実験材料・機器など
大腸菌および培養液、EzBactYeast Crusher (WSE-7423)、蒸留水、マイクロ遠心チューブ、ピペットチップ、遠心機、マイクロピペットなど
1.大腸菌の培養
大腸菌を適当な培地でO.D.600=0.5~1.0になるまで培養します(菌体量としては50~100 mg相当です)。
大腸菌発現タンパク質を抽出する場合は、発現用大腸菌および発現タンパク質に適切な条件下で培養することを推奨します。
2.集菌および洗浄

大腸菌を2,000xgで5分間遠心して集菌します。遠心沈査に5~10mL の蒸留水を加えて懸濁し、再度、2,000xgで5分間遠心して集菌します。
※洗浄後の遠心沈査(菌体)は-80℃で凍結保存可能です。一般的に、一度凍結した方が抽出効率は上がります。
3.菌体の溶解
遠心上清を捨て、菌体をボルテックスして細胞塊をよくほぐします(重要)。
0.5mLのEzBactYeast Lysis bufferを添加し、室温で10分間静置します。
※EzBactYeast Lysis bufferにはあらかじめEzBactYeast Crusherキット添付のProtease InihibitorとDNase Iを添加しておきます。
4.タンパク質の抽出
細胞溶解液を10,000xg (4℃)で5分間遠心し、遠心上清を回収します。
※不溶性タンパク質は遠心沈査に回収されます。不溶性タンパク質を抽出する際は、遠心沈渣に8M 尿素含有緩衝液や6M グアニジン塩酸含有緩衝液などを添加して溶解し、タンパク質を抽出してください。
一般的な大腸菌タンパク質の抽出方法
-
大腸菌を破砕用溶液(50 mM Tris/pH8.0, 500 mM NaCl, 15% glycerol, 10 mM imidazole)で3回洗浄する。
-
細胞塊を3倍容量のSonication bufferに懸濁し、終濃度が1 mg/mL Lysozyme、1 mM DTT、0.5 mM EDTAになるように添加する。
-
大腸菌が破砕されるまで、冷却しながら、超音波破砕を行う(顕鏡確認)。
-
終濃度が0.1 mg/mL DNase Iになるように添加する。
-
遠心(10,000g~25,000g × 10~30分)して、上清を回収する。
実験例1:抽出効率
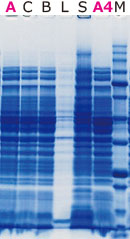 |
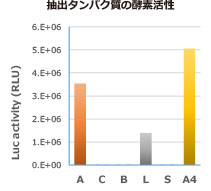 |
抽出に使用した試薬 A: EzBactYeast Crusher (室温) C: 他社市販試薬 B: 他社市販試薬 L: Lysozyme S: SDSサンプルバッファー A4:EzBactYeast Crusher (4℃) M: EzProtein Ladder |
図はルシフェラーゼ発現大腸菌から右記の試薬を使用してタンパク質を抽出し、電気泳動した結果(左)と酵素活性を測定した結果(右)を示しています。
アトーのEzBactYeast Crusherは室温でも低温(4℃)でも同様に、他社市販試薬と同等以上の抽出効率でタンパク質を回収できます。
また上記グラフに示されたように、室温で抽出した場合でも、酵素活性を高く保持した状態でタンパク質が抽出可能なことが分かります。
実験例2:発現タンパク質の精製
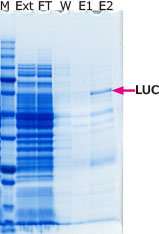 |
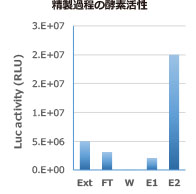 |
M: EzProtein Ladder Ext: Whole Extract FT: Flow through W:Wash E1: Extraction 1 E2: Extraction 2(Purified protein) |
図はHis tag‐ルシフェラーゼ発現大腸菌からEzBactYeast Crusherを使用して抽出したタンパク質をNi-Sepharoseカラムで精製した結果を示しています。EzBactYeast Crusherは、カラムへの結合、各精製ステップの反応を阻害することなく、また酵素活性も保持した状態でタンパク質を精製できます。このようにEzBactYeast Crusherは、大腸菌系発現タンパク質の抽出・精製にも適していることが示されました。
酵母からのタンパク質抽出方法
酵母には多糖類を主成分とした硬質の細胞壁があるため、大腸菌よりも破壊するのが困難です。一般的にはガラスビーズなどの研磨剤を加えたホモジェナイズ、フレンチプレスなどの加圧減圧処理による破砕、超音波破砕、ザイモリアーゼなどの酵素によりプロトプラスト化してからの溶解などが主流です。しかし、物理的破壊は抽出効率は高いものの、操作が煩雑で物理的ダメージが大きく、またプロトプラスト化も条件の至適化が難しいといわれています。アトーのEzBactYeast CrusherはプロテアーゼインヒビターとDNase Iが付属されており、ガラスビーズ法に匹敵した抽出効率で、菌体に混ぜるだけでタンパク質を安定に抽出可能です(分裂酵母は抽出効率が下がります)。
実験方法
実験材料・機器など
菌体および培養液(10mL)、EzBactYeast Crusher (WSE-7423)、蒸留水、マイクロ遠心チューブ、ピペットチップ、遠心機、マイクロピペット等
1.酵母の培養
酵母を適当な培地でO.D.600=0.5~1.0になるまで培養します(菌体量としては50~100 mg相当です)。
※発現タンパク質を抽出する場合は、発現用酵母および発現タンパク質に適切な条件下で培養することを推奨します。
2.集菌および培養
酵母を2,000xgで5分間遠心して集菌します。遠心沈査に5~10mL の蒸留水を加えて懸濁し、再度、2,000xgで5分間遠心して集菌します。
※洗浄後の遠心沈査(菌体)は-80℃で凍結保存可能です。一般的に、一度、凍結した方が抽出効率は上がります。
3.前処理
遠心上清を捨て、菌体をボルテックスして細胞塊をよくほぐします(重要)。0.5mLのYeast PreLysis bufferを添加してボルテックスし、室温で5分間静置します。
※実験系に支障がない場合は、DTTを5~50mM添加するとタンパク質抽出効率が上がります。
4.菌体の溶解
細胞懸濁液を10,000xgで5秒間(4℃)遠心し、回収した菌体をボルテックスして細胞塊をよくほぐします(重要)。0.5mLのEzBactYeast Lysis bufferを添加し、室温で10分間静置します。
※EzBactYeast Lysis bufferにはあらかじめEzBactYeast Crusherキット添付のProtease InihibitorとDNase Iを添加しておきます。
※抽出効率を上げる場合は、酸洗浄ガラスビーズ(φ 0.5mm)を使用します(分裂酵母は必須)。
5.タンパク質の抽出
細胞溶解液を10,000xg (4℃)で5分間遠心し、遠心上清を回収します。
一般的な酵母タンパク質の抽出方法
-
酵母を破砕用溶液(0.33M Sucrose, 0.3M Tris/pH8.0, 1mM EDTA, 1mM EGTA, 2mM DTT, 100mM 6-Aminohexanoic acid)で洗浄する。
-
砕容器に菌体を入れ、容器の40%容量のガラスビーズ(酸洗浄済み)を添加する。
-
ビーズ破砕機にセットし1分間のパルスで3~5分間破砕する。
-
破砕後、必要であれば1M Tris/pH7.4を添加してpH調整する。
-
14,000xgで30分間遠心して上清を回収する。
実験例3:酵母タンパク質抽出効率の比較
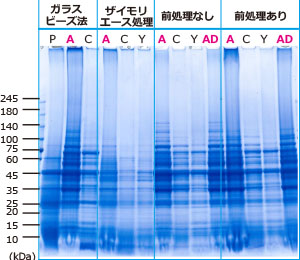 |
抽出に使用した試薬 P: PBS A: EzBactYeast Crusher C: 他社市販試薬 Y: 他社市販試薬 AD:EzBactYeast Crusher+5mM DTT |
図はYPD培地で培養した出芽酵母(Saccharomyces cerevisiae)5mL の培養液から細胞を回収し、記載の方法でタンパク質を抽出して、電気泳動を行った結果を示しています。
ガラスビーズ法は細胞の約2.5倍容量のガラスビーズと各抽出液を0.2mL 添加し、10分間ボルテックスを行うことによりタンパク質を抽出しました。
ザイモリエース処理法は5mg/mLのザイモリエースで37℃で30分間処理した後に、細胞をPBSで洗浄し、
さらに細胞に各抽出液を0.2mL 添加し10分間インキュベーションしてタンパク質を抽出しました。
前処理なしおよび前処理ありは、細胞に各抽出液を0.2mL 添加して10分間インキュベーションすることによりタンパク質を抽出しました。
前処理はタンパク質抽出前に、EzBactYeast Crusherに添付されたPre-Lysis bufferを細胞に加えて10分間インキュベーション処理しました。
ガラスビーズ法、ザイモリエース処理法を含め、EzBactYeast Crusherで抽出したレーン(A)のタンパク質は、
その他の抽出試薬のレーンに比べてタンパク質バンドが多く、濃度も濃いことが示されました。
とくに溶出が困難な高分子領域のタンパク質の抽出効率が高く、様々なタンパク質が高効率に溶出できることが判ります。
実験例4:酵母抽出タンパク質の免疫沈降
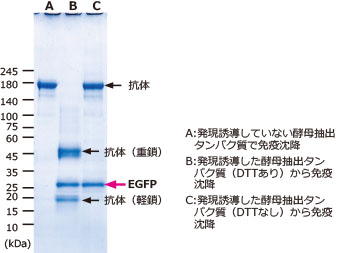 |
 |
図はV5 tag‐EGFP発現酵母からEzBactYeast Crusherを使用して抽出したタンパク質を、V5抗体を使用して免疫沈降した結果を示しています。
写真は抽出後のタンパク質をBlue LEDで励起してEGFPの蛍光をとらえた像です。
電気泳動パターンのレーンAは発現誘導していないため、EGFPのバンドは検出されていません。
しかし発現誘導したレーンBとCには明瞭にEGFPのバンドが検出されました。
またレーンBは還元剤であるDTT を添加した状態でタンパク質を抽出したため、免沈で使用した抗体由来のバンドも還元され重鎖(75kDa)と軽鎖(25kDa)に分かれています。
一方、レーンAとCは還元剤を添加せずに抽出したため、抗体は還元されておらず、150kDaのバンドとして検出されました。
このように、EzBactYeast Crusherを使用して抽出したタンパク質はタンパク質の変性が最小限に抑えられているため、コンプレックス(抗原サイトおよび抗体)が壊れることなく、また活性を保った状態(EGFP蛍光)であることが判ります。
動物細胞からのタンパク質抽出方法
比較的柔らかい組織の場合Potter型ホモジェナイザーが、また大量の組織を取り扱う場合はワーリングブレンダーやミキサーなどが利用されています。もちろん微生物と同様に超音波破砕や凍結融解法による破砕も用いられます。また動物細胞には細胞壁がないため、浸透圧ショックにより細胞膜を破壊しオルガネラ等を分画する方法があります。ある種の酵素の抽出には有機溶媒(アセトン)による抽出法が利用されます。その他、酵素や界面活性剤を利用した抽出方法も一般的によく用いられます。アトーのEzRIPA Lysis kitはプロテアーゼインヒビターとホスファターゼインヒビターが付属されており、細胞に混ぜるだけでタンパク質を安定に抽出可能です。
実験方法
実験材料・機器など
培養細胞(10cmディッシュ、5~20x106細胞)、EzRIPA Lysis kit(WSE-7420)、EzPBS(-) (WSE-7430, 10x濃度)、マイクロ遠心チューブ、ピペットチップ、遠心機、マイクロピペット等
1.細胞の培養

細胞を適当な培地でコンフルエントになるまで培養します(5~20×106細胞相当)
※使用する細胞によって、細胞の大きさや密度によって回収される細胞数は異なります。
3.細胞の溶解
1.0mLのRIPA Lysis bufferを添加して氷上で15分間静置します。
※RIPA Lysis bufferにはあらかじめEzRIPA Lysis kit添付のProtease InihibitorとPhosphatase inhibitorを添加します。
※浮遊細胞は遠心沈渣にRIPA Lysis buffer(調製済み)を添加してピペッティングにより懸濁し、氷上に15分間静置します。
4.抽出液の回収
細胞をスクレイパー等でかきとり、マイクロ遠心チューブに回収します。この細胞抽出液を15,000xgで5~15分間(4℃)遠心します。
※浮遊細胞も上記と同様に遠心します。
5.タンパク質の回収
遠心上清を新しいマイクロ遠心チューブに回収します。可溶化したタンパク質溶液は使用時まで氷上で静置、もしくは-80℃で保存してください。
※核タンパク質も抽出する場合は、SDSを最終濃度が0.5%になるように添加すると抽出効率が上がります。DNAの溶出により粘性が上がるため、超音波破砕あるいはDNase Iで処理します。
一般的な動物細胞タンパク質の抽出方法
動物組織・細胞からタンパク質を抽出するためにはサンプルを破壊する必要があります。一般的に生体サンプルを破壊する方法としては
-
細断・摩砕(溶媒をサンプルの3~10倍添加してホモジェナイズする)
-
超音波破砕(50mg/mL以下の濃度で1~10分冷却しながら超音波をかける)
-
凍結融解
-
加圧破砕(フレンチプレスなどの)
-
浸透圧ショック(pH、イオン強度の変化)
-
有機溶媒(アセトン、アルコールにより脂質膜構造を破壊)
-
酵素処理(細胞壁の酵素破壊など)
-
界面活性剤の利用
などがあげられます。
オルガネラからのタンパク質抽出方法
細胞内のタンパク質には細胞質や核、ミトコンドリアなどある特定の領域に局在するものがあります。これらのタンパク質は、刺激応答や細胞周期などの影響を受けて局在や機能が変化する場合があります。一方で、細胞全体には非常に多くのタンパク質が存在するため、ターゲットタンパク質の同定や単離・精製が難しい場合があります。このような場合、細胞を細胞小器官ごとに分けて解析することで、タンパク質を絞りこむことができ、ターゲットタンパク質の同定や機能解析をより簡単に行うことが可能になります。アトーのEzSubcell ExtractはプロテアーゼインヒビターとDNase Iが付属されており、細胞に混ぜるだけで細胞質分画、核分画、ミトコンドリアなどの膜分画、不溶性分画それぞれを分離・抽出可能です。
実験方法
実験材料・機器など
培養細胞(10cmディッシュ、5~20x106細胞)、EzSubcell Extract (WSE-7421)、EzPBS(-) (WSE-7430, 10x濃度)、マイクロ遠心チューブ、ピペットチップ、遠心機、ボルテックスミキサー、マイクロピペット等
1.細胞培養

細胞を適当な培地でコンフルエントになるまで培養します(5~20×106細胞相当)
※使用する細胞によって、細胞の大きさや密度によって回収される細胞数は異なります。
3.細胞質の抽出

細胞に氷冷した1mLのExtraction buffer 1を添加後、ボルテックスで混合し、4℃で10分間インキュベートします。
700×gで5分間(4℃)遠心し、遠心上清をマイクロ遠心チューブに回収します(細胞質分画)。
4.膜分画の抽出
遠心沈渣に氷冷した1mLのExtraction buffer 2を添加後、ボルテックスで混合し、4℃で30分間インキュベートします。
4,000×gで5分間(4℃)遠心し、遠心上清をマイクロ遠心チューブに回収します(膜分画)。
※膜分画にはミトコンドリア、ゴルジ体、小胞体などが含まれます。
5.核分画の抽出
遠心沈渣に氷冷した0.5mLのExtraction buffer 3を添加後、ボルテックスで混合し、4℃で60分間インキュベートします。
9,000×gで5分間(4℃)遠心し、遠心上清をマイクロ遠心チューブに回収します(核分画)。
6.不溶性分画の抽出
細胞に室温の0.5mLのExtraction buffer 4を添加してボルテックスして溶解します。
実験例5:核分画におけるオルガネラマーカーの検出
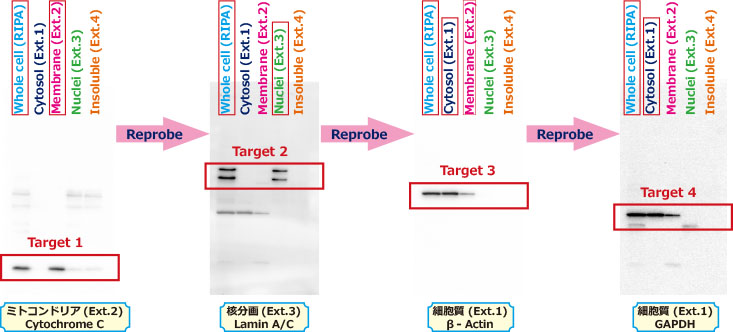
ヒト結腸癌由来細胞SW480(2×107個細胞)からEzRIPA Lysis kitおよびEzSubcell Extracを使用して、全細胞(Whole cell)、細胞質(Cytosol, Ext.1)、膜分画(Membrane Ext.)、核分画(Nuclei, Ext.3)、不溶性分画(Insoluble, Ext.4)のタンパク質を抽出し、EzApplyを使用して電気泳動サンプルを調製しました。ePAGEL(5-20%濃度勾配ゲル)で分離し、EzFastBlotを使用してP plus膜に転写して、EzBlock CASで30分ブロッキングしました。ブロッキング後の膜をミトコンドリアマーカーのCytochrome C抗体、次いでHRP標識2次抗体と反応し、EzWestLumi plusで検出した結果が上図左側の写真です。全細胞抽出液と膜分画にのみバンドが検出されており、ミトコンドリアを含む膜分画が、他オルガネラのコンタミなく分離されていることが示されました。このブロッティング膜からEzReprobeとの反応により抗体を剥離し、再びEzBlock CASでブロッキングした後に、核マーカーのLaminA/C抗体およびHRP標識2次抗体と反応してEzWestLumi plusで検出した結果が左から2番目の写真です。全細胞抽出液と核分画にのみバンドが検出されており、核分画もまた他オルガネラのコンタミなく分離されたことが判ります。再度、同様に抗体剥離、ブロッキングを行い、βアクチン抗体と反応させて検出した結果が左から3番目の写真です。右側の写真はさらに同じ膜を使用して、抗体剥離、ブロッキングを行い、GAPDH抗体と反応して検出した結果です。細胞質マーカーであるβ‐アクチン とGAPDHは全細胞抽出液と細胞質分画にバンドが検出されましたが、膜分画にも検出されており、細胞質分画が膜分画にわずかに混在することが示されました。しかし、上述の実験では省きましたが、EzSubcell Extractによるオルガネラ分画の抽出法は、抽出時のさらなる洗浄操作を行うことにより、よりコンタミなく各オルガネラ分画を抽出することが可能です。このようにEzSubcell Extractは各オルガネラ分画を細胞と混ぜるだけで抽出することができ、EzReprobeと組み合わせることにより、僅かで貴重なサンプルからであっても、多くのタンパク質の発現を調べることが可能になります。
実験例6:抽出液のタンパク質量と核染色像
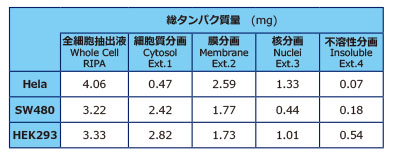
EzSubcell Extractにより、コンフルエントになった1枚の培養ディッシュ(φ10cm、細胞数は 1∼2×107個)から各細胞株のオルガネラ抽出液を調製しました。Whole cell の抽出液はEzRIPA Lysis kitにより、同様にコンフルエントの培養ディッシュ1枚から調製しました。タンパク質濃度はBCA法により定量しました。
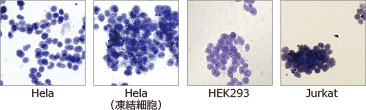
EzSubcell ExtractのExtraction buffer 2で処理した後の遠心沈渣を、トリパンブルー染色して観察した結果です。核の形状に異常がなく、核膜が保持された状態で単離されていることが示されました。凍結保存した細胞からも同様に核の単離及び各オルガネラの抽出液を単離することができます。