テクニカルインフォメーション
ポリアクリルアミドゲルの調製
電気泳動はタンパク質固有の電荷や分子量の違いを利用して、電気で各分子を分離する手法です。最もよく使用されるSDS-PAGE (SDS Polyacrylamide gel electrophoresis) は、タンパク質にSDS を付加して負に帯電させ、アクリルアミドゲルのメッシュ構造を利用して、タンパク質の分子量の違いでふるい分けます。今回はアトーの製品を使用したポリアクリルアミドゲルの調製方法に関してご紹介します。
実験の流れ
1.プレートの組み立て

必要なゲルの枚数に応じて、自作ゲル作製キットもしくは多連ゲル作製器を組み立てます。
使用する製品
自作ゲル作製キット、多連ミニゲル作製器
2.ゲルの調製

ゲルの調製に必要な試薬の準備をします。ゲル溶液は作製直前に混合します。目的タンパク質により、アクリルアミドの濃度を変えます。
使用する製品
ゲルバッファー溶液
(EzGel Ace, EzGel Sep, EzGel Stack)
機器・試薬・材料
- EzGel Ace / EzGel Stack / EzGel Sep・・・ゲル緩衝液
- アクリルアミド/ビス混合液・・・アクリルアミドモノマー
- APS (過硫酸アンモニウム)・・・重合開始剤
- TEMED(N,N,N',N',-テトラメチルエチレンジアミン)・・・重合促進剤
- 蒸留水
- ゲル作製器 / 多連ゲル作製器
- ゲルプレート
- コウム
- スペーサー
ストック溶液
(A) アクリルアミド/ ビス溶液
アクリルアミド/ ビス混合溶液は分画分子量範囲に応じて、19:1、29:1、37.5:1 などの架橋率の溶液が使用されます。
架橋率が高い溶液ほど低分子量側の、また架橋率が低いほど高分子量側の分画範囲が広がります。
下表の目的分画範囲に応じて選択、ご準備ください。
※下記タンパク質分画分子量範囲はLaemmli法によるものです。泳動バッファーの種類によって変わります。
| ゲル濃度 | 分画分子量範囲 | |
|---|---|---|
| タンパク質[Da] | DNA[bp] | |
| 7.5% | 40,000 ~ 400,000 | 200 ~ 3000 |
| 10% | 20,000 ~ 300,000 | 100 ~ 2000 |
| 12.5% | 10,000 ~ 250,000 | 70 ~ 1800 |
| 15% | 2,000 ~ 200,000 | 50 ~ 1500 |
| 5~20% | 5,000 ~ 400,000 | 30 ~ 2500 |
| 10~20% | 2,000 ~ 300,000 | 30 ~ 2000 |
【30(w/v)% アクリルアミド/ビス(29:1)溶液】
29 g のアクリルアミドと 1 g の N,N'- メチレンビス(アクリルアミド)を秤量し、50 mL の蒸留水に溶解します。溶解後、蒸留水で100 m Lにメスアップします。
※アクリルアミドのモノマーには神経毒性があります。取扱う場合には手袋など身体の保護を行ってください。
(B) ゲル緩衝液
EzGel Ace 中性のゲル緩衝液であり、濃縮および分離ゲルに使用できます。作製したゲルは長期冷蔵保存可能(約1か月)です。
EzGel Stack Laemmli法に準拠した濃縮ゲル用緩衝液です。0.5 M Tris-HCl (pH6.8)相当のバッファーです。
EzGel Sep Laemmli法に準拠した分離ゲル用緩衝液です。1.5 M Tris-HCl (pH8.8)相当のバッファーです。
※ゲル緩衝液にはEzGel Ace単独、もしくはEzGel StackとEzGel Sepの組み合わせでご使用ください。
(C) 10% APS (過硫酸アンモニウム)
0.1 gのAPSを秤量し、1 mLの蒸留水に溶解します。
※10% APSは徐々に活性が落ちるため、要時調整することをお勧めします。冷蔵庫で1週間位保存可能です。
(D) TEMED(N,N,N',N'-テトラメチルエチレンジアミン)
原液をそのまま使用します。
主な電気泳動用試薬の組成
電気泳動で使用する主な試薬の組成です。より再現性良く、簡便に実験を行う際はパジェルなどの既製ゲルやアトー試薬をご利用ください。
| 電気泳動用試薬 | 組成 |
|---|---|
| SDSサンプルバッファー(×5) | 250mM Tris-HCl (pH6.8)、8% SDS、0.1%Bromophenol blue、40% Glycerol、100 mM DTT |
| Nativeサンプルバッファー(×5) | 250mM Tris-HCl (pH6.8)、0.1%Bromophenol blue、40% Glycerol |
| アクリルアミドストック溶液 | 30 % Acrylamide/N,N'-methylene-bisacrylamide (29:1) |
| 泳動用緩衝液 | 25mM Tris、192mM Glycine、0.1% SDS (SDS を除いた上記泳動バッファーはNative PAGE で使用可能です) |
| CBB染色液 | 0.25% Coomassie Brilliant Blue、40% メタノール、7% 酢酸 |
| 脱色液 | 40% メタノール、7%酢酸 |
実験方法
アトー製のAE-6401 ミニスラブゲル作製キットを使用して、ゲルを調製する方法をご紹介します。

1.プレートを組み立てます。スペーサーを上面にしてノッチ泳動プレートをおきます 。
泳動プレートの上端と、シールガスケットの上端の位置をそろえます。スペーサーとシールガスケットが重なり合わないようにします。

2.プレーン泳動プレートとノッチ泳動プレートを、シールガスケットがずれないように注意しながら重ねます。

3.泳動プレート下端から約5mm 上の位置で、マグネクリップミニをはさんで固定します。プレートおよびガスケットがずれないように注意します。

4.分離ゲルを注入するときの目印として、コウムの先端から約5mm 下に油性ペンで目印を付けます。

5.コウムを外し、泳動プレートセットを水平な実験台上に垂直に立てます。プレートが水平になるように、クリップの位置を調整します。
6.ゲル溶液の調製をします。ゲル組成表(左表)に従い、分離ゲルと濃縮ゲルのゲル溶液を作製します。
※APSとTEMED以外の溶液を混合します。
| 分離ゲル | 濃縮ゲル | ||||
|---|---|---|---|---|---|
| ゲル濃度 | 7.5% | 10% | 12.5% | 15% | 4.5% |
| 蒸留水 | 5mL | 4.2mL | 3.3mL | 2.5mL | 3mL |
| アクリルアミド/ビス溶液 | 2.5mL | 3.3mL | 4.2mL | 5mL | 0.75mL |
| ゲル緩衝液 | 2.5mL | 2.5mL | 2.5mL | 2.5mL | 1.25mL |
| 10% APS | 0.075mL | 0.05mL | 0.05mL | 0.05mL | 0.05mL |
| TEMED | 0.005mL | 0.005mL | 0.005mL | 0.005mL | 0.003mL |

7.分離ゲル溶液にAPS とTEMED を添加し、泡立てないように混合し、ゲルプレートに分離ゲル溶液を流し込みます。
分離ゲル溶液を泳動プレートの切り欠きの部分から静かに注ぎ入れます。勢いよく注ぐと重合ムラが生じる要因になります。分離ゲル溶液は、目印の高さまで注いでください。

8.界面を乱さないように気をつけながら、蒸留水を重層します(0.2~ 1.0 mL)。
※アクリルアミドは酸素があると重合しにくいため、蒸留水を重層することで空気中の酸素を遮断します。

9.室温で30 分以上静置して重合します。
※ゲルの界面が明瞭に見えることを確認してください。重合時間は季節や室温によって変わります。20℃以下では重合しにくくなるので、ご注意ください。

10.重層した蒸留水をペーパータオルなどに吸わせて完全に除きます。

11.濃縮ゲル溶液にAPS とTEMED を添加して泡立てないように混合し、分離ゲルの上に濃縮ゲルを重層します。

12.コウムを差し込み、室温で30 分以上静置して重合します。コウムは水平になるように差し込み、コウムのウェル部分に空気泡がつかないように注意します。
※ EzGelAce を使用して作製したゲルは、ラップ等で包み、蒸留水で4 倍希釈したEzGelAce を約5mL(ゲル一枚当たり)入れたハイブリバック等に密閉して冷蔵庫で約一か月保存可能です。
※Laemmli 法のゲルバッファーで作製したゲルは保存できませんので、即日ご使用ください。
参考データ
実験例1:アクリルアミド濃度と泳動バッファーの影響
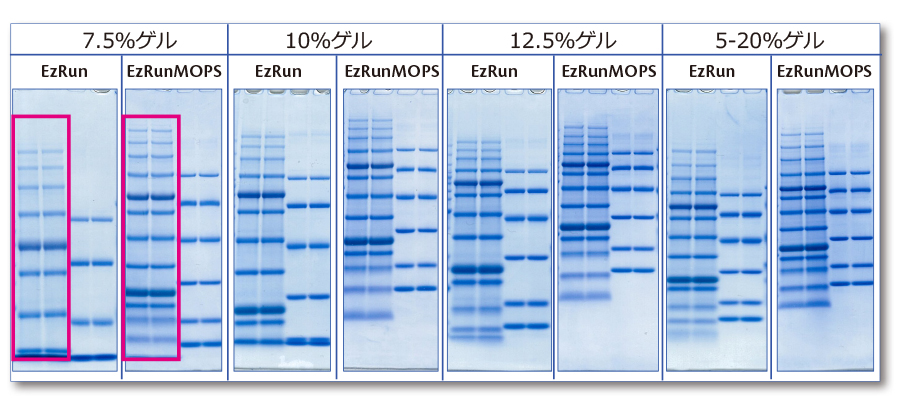
上図は分子量マーカータンパク質を様々なアクリルアミド濃度のポリアクリルアミドゲルを使用し、泳動バッファーが異なる条件、EzRun (左)とEzRun MOPS(右)で電気泳動した結果です。
例えば7.5% 濃度のゲルを用いて分離した結果(左端カラム)をみると、EzProteinLadderのパターン(各ゲルの右側2 レーン)が、EzRunでは8本のバンドが検出されたのに対して、
EzRun MOPS では12本のバンドが検出されています。
このようにEzRun MOPS を使用すると、低分子量側の分離範囲が広がり、より明瞭に分離できるようになります。
実験例2:ゲルバッファーおよび既製ゲルとの比較
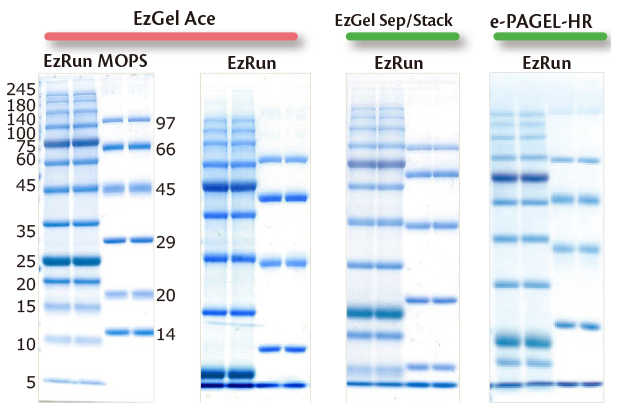
上図は分子量マーカータンパク質を10% アクリルアミド濃度のポリアクリルアミドゲルを使用して分離した結果です。
左側2 枚のゲルはEzGelAceを使用し、その隣はEzGel Sep およびEzGel Stack を使用して自作したゲルの泳動結果です。
右端のゲルは既製ゲルePAGEL-HR を使用した泳動結果です。
またEzGelAce で自作したゲルは、異なる泳動バッファーEzRun MOPS(左)とEzRun (右)で泳動し、それ以外のゲルは全てEzRun で電気泳動しました。
ゲルバッファーが異なると、同じアクリルアミド濃度のゲルでも、若干異なる移動度を示すことが判ります。
また実験例1 でも示しましたが、泳動バッファーが異なってもタンパク質の移動度は影響を受け、EzRun MOPS を使用すると低分子量側のタンパク質がより明瞭に分離できるようになります。
つまり泳動バッファーをEzRun MOPSに変えるだけで、10%の濃度均一ゲルが、まるで濃度勾配ゲルのようなバンドパターンを示すようになります。
このようにゲルバッファーや泳動バッファーを変えることで、同じアクリルアミド濃度のゲルを使用しても、タンパク質の分離範囲は影響されます。
資料ダウンロード
動画で紹介
ミニサイズゲルの作製方法