テクニカルインフォメーション
電気泳動用の試料調製
電気泳動はタンパク質固有の電荷や分子量の違いを利用して、電気で各分子を分離する手法です。分子量や等電点の概算など解析目的に応じてSDS-PAGE やNative PAGE、2次元電気泳動などの様々な電気泳動方法が活用されています。一方、サンプル調製方法は電気泳動方法により異なります。今回はアトーの製品を使用した電気泳動サンプルの調製方法に関してご紹介します。
実験の流れ
2.加熱処理
SDS-PAGE 用の泳動サンプルは、SDS や還元剤を含有するサンプルバッファーと混合後、95℃で3 ~10 分間加熱してSDS および還元処理を行います。
使用する製品
ブロックインキュベータ
(MyMini Block)
SDS-PAGE用サンプルの調製
SDS-PAGEは分子量の概算や精製度の解析に使用される泳動方法です。泳動用サンプルはSDSと還元剤が添加された試薬で調製するため、タンパク質コンプレックスは解離し、リニアライズされた後にSDSが付加されるため(~1.4g of SDS/g of Protein)、タンパク質の電荷や構造が無視できるといわれています。
実験材料
組織・細胞・細菌等、EzApply(AE-1430)、マイクロ遠心チューブ、チップ、遠心機、ピペットマン等
実験方法
1.50μLのサンプルに50μLのEzApply (2×濃度、DTT添加済み)を加えて混合します。
2.MyMiniBlockで95℃5分間加熱します(煮沸でもOK)。
3.15,000rpmで5分間遠心し(しなくてもOK)上清を回収します。
※作製したサンプルは-20℃で保存可能です。
※組織や細胞などを直接溶解する際は、EzApplyを蒸留水で1×濃度に希釈します。
組織及び細胞塊の2.5~3倍容量の1×EzApplyを添加し、解剖ハサミによる細断やホモジェナイズ等を行って完全に溶解します。
溶解後の抽出液は上述の方法と同様に加熱し、遠心後の上清を別のチューブに回収します。
参考データ:抗体の希釈濃度の影響
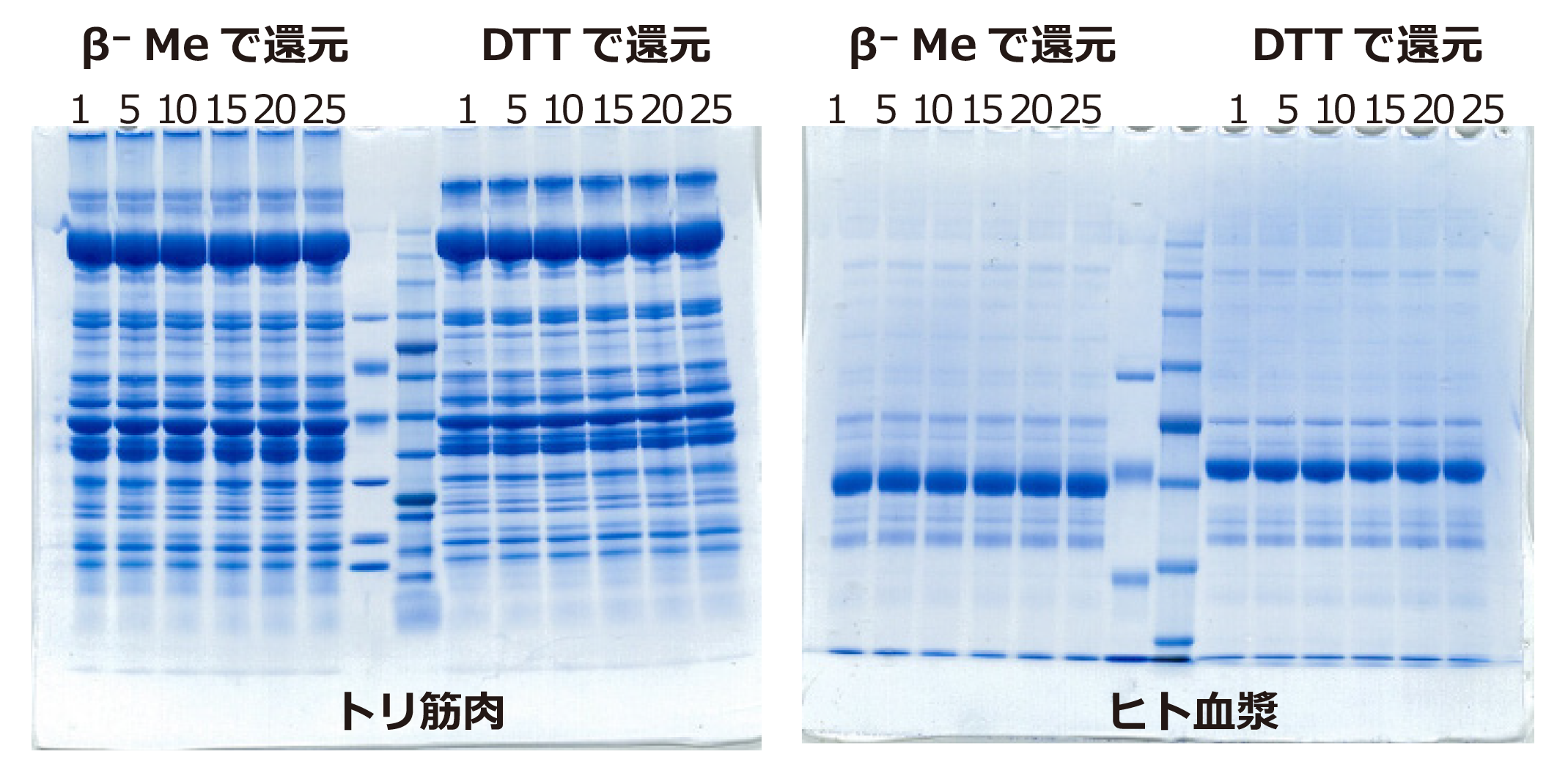
上図はトリ筋肉およびヒト血漿タンパク質をEzApplyで抽出し、電気泳動サンプルを調製して電気泳動をした結果です。
トリ筋肉はePAGEL (E-T520L)で、ヒト血漿タンパク質はePAGEL (E-T7.5L)で分離し、泳動後のゲルはEzStain AQuaで染色しました。
また抽出する際に、β⁻メルカプトエタノール(β⁻Me)を使用した場合(ゲルの左サイド)とDTTを使用した場合(ゲルの右サイド)を比較しました。
還元剤の違いにより、バンドの形状やパターンが若干異なることが判ります。
特にヒト血漿タンパク質のバンドでは顕著に示されていますが、DTTを還元剤として使用した方が、よりバンドがシャープに分離されます。
各レーンの上部に表示された数字は、電気泳動サンプル調製後に凍結融解を繰り返した回数を示しています。
いずれの還元剤を使用した場合も、20回程度の凍結融解により顕著な劣化は生じないことが示されました(タンパク質の性状や、凍結⁻融解温度や方法等により影響されます)。
蛍光標識サンプルの調製
EzLabel FluoroNeoはSDSサンプルバッファーの代わりにタンパク質溶液と混ぜて加熱するだけで、タンパク質の蛍光標識と電気泳動用サンプル調製ができます。電気泳動後のゲルは、すぐに、Blue LEDあるいはUVで励起することにより、バンドが検出できます[Ex: 330 (UV), 470 nm, Em: 530 nm]。
実験材料
組織・細胞・細菌等、EzLabel FluoroNeo(WSE-7010)、マイクロ遠心チューブ、チップ、VariRaysⅠ/Ⅱ (WSE-5510/5520)、遠心機、ピペットマン等
実験方法
1.EzLabel FluoroNeoを使用します。40 μLのタンパク質サンプルにキット添付の10 μLのSample buffer (5x conc.) とLabeling reagent を0.5 μL添加して混合します。
2.MyMiniBlockで95℃3分間加熱します(煮沸でもOK)。
3.2.の混合液にReducing agent (DTT)を2μL 添加して混合します。
4.MyMiniBlockで95℃3分間加熱します(煮沸でもOK)。
※作製したサンプルは-20℃で遮光保存可能です。
※サンプルの溶媒にTrisなどのアミノ基が含まれると、非特異的なシグナルが出る原因になります(泳動後のゲルを蒸留水で洗浄すると非特異的シグナルは消失します)。
※サンプル中に還元剤が含まれると蛍光標識反応を著しく妨げる原因となります。標識後に還元処理をしてください。
※蛍光標識タンパク質はウェスタンブロット解析に使用することができます。蛍光シグナルを利用して転写効率等を確認することが可能です。
参考データ:EzLabel FluoroNeo標識サンプル
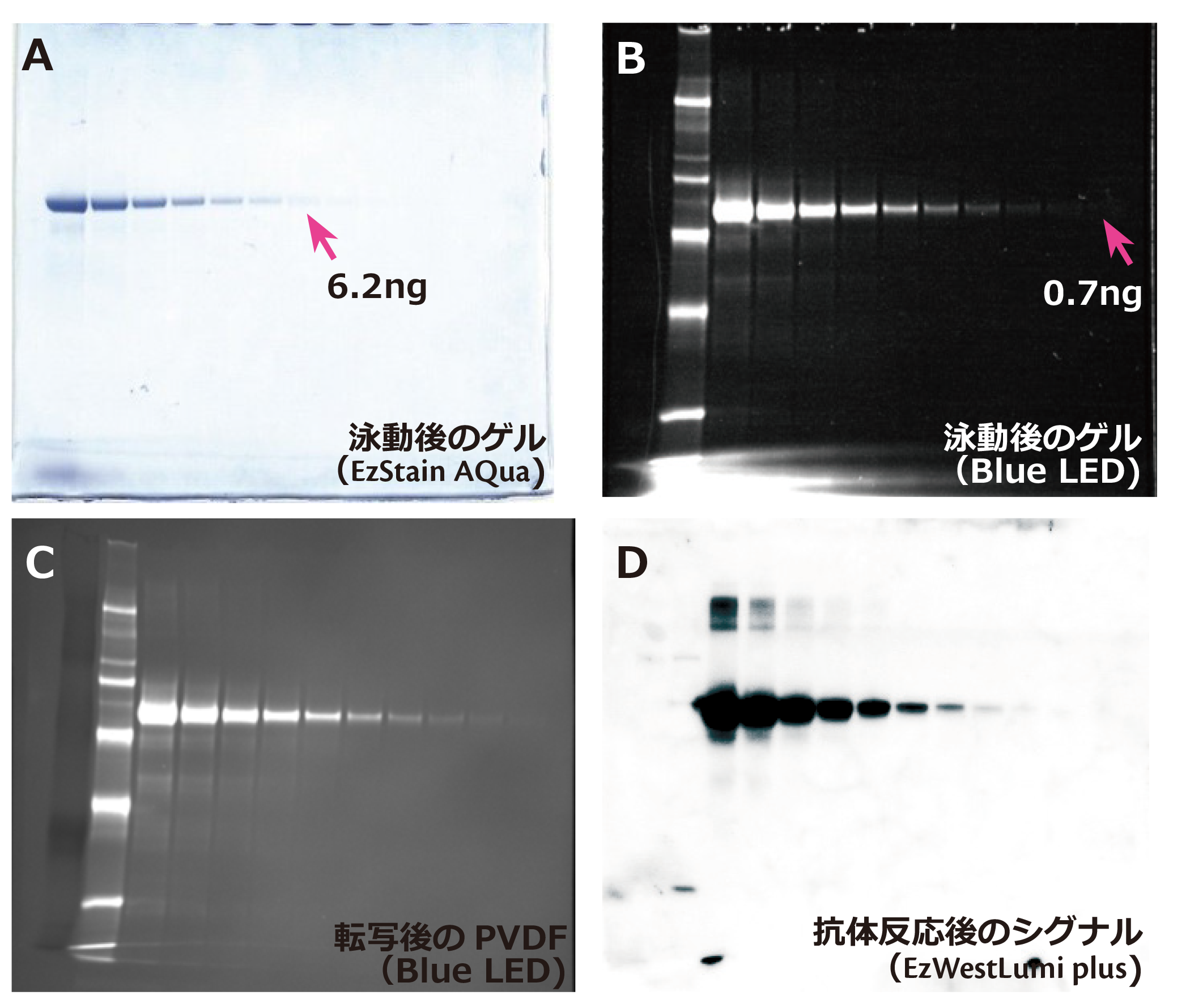
上記写真のAはヒトトランスフェリンタンパク質をEzApplyで処理して400 ng/レーンからの1/2希釈系列で電気泳動し、EzStain AQuaで染色した結果を示しています。
写真B~Dはヒトトランスフェリンタンパク質をEzLabel FluoroNeoで処理した電気泳動サンプルを使用しています。
写真B は蛍光標識後のタンパク質を400 ng/レーンからの1/2希釈系列で電気泳動し、泳動後のゲルをBlue LEDで励起し、540LPフィルターを使用して撮影した結果を示しています。
撮影後のゲルはEzFastBlotで軽く洗浄し、EzFastBlotを使用してP plus(PVDF)膜に転写しました。
写真Cは転写後の膜をゲルと同様にBlue LEDで励起し、540LPフィルターを使用して撮影した結果を示しています。
転写後の膜はEzBlock Chemiでブロッキング後、抗ヒトトランスフェリン抗体およびHRP標識2次抗体と抗体反応しEzWestLumi plusで検出しました(D)。
このようにEzLabel FluoroNeoで蛍光標識したタンパク質は、CBB染色したゲルよりも検出感度が高く、電気泳動後のタンパク質を直ちに検出でき、また転写後のPVDF上のタンパク質もBlue LEDで容易に可視化して転写効率や転写ムラの有無等を確認することが可能です。
さらにウェスタンブロッティングの抗体反応を妨げることなく、特異的なシグナルを検出することができます。
参考ページ:ウエスタンブロッティングの基本操作ウエスタンブロッティング トランスファー(転写)ウエスタンブロッティング ブロッキングウエスタンブロッティング 抗体反応と検出もご覧ください。
等電点電気泳動用サンプルの調製
2次元電気泳動は1次元目に等電点電気泳動を、2次元目にSDS-PAGEを行って分離します。等電点電気泳動はタンパク質固有の電荷(等電点:pI)を利用して分離する方法です。泳動サンプルは高濃度の尿素で抽出し、還元処理を行うため、タンパク質の立体構造は無視できるといわれています。
実験材料
組織・細胞・細菌等、EzApply 2D kit(AE-1435)、マイクロ遠心チューブ、チップ、超音波破砕装置、VariRaysⅠ/Ⅱ (WSE-5510/5520)、遠心機、ピペットマン等
実験方法
1.組織は生理食塩水等で洗浄後、解剖用ハサミで細断します。細断後の組織および細胞、細菌をキット添付の1 mLのWash buffer で洗浄します。
2.遠心(4,000 rpmで10~60秒間)し上清を廃棄します。
3.遠心沈査の2.5~3倍容量のSolution 2(キット添付)を添加し、超音波破砕します。
※DNAが抽出されるため、溶媒の粘性が高まりますが、超音波破砕により軽減します。
※可溶性成分と不溶性成分を分けて抽出する場合は、Solution 1(キット添付)を使用し、2段階抽出します。詳しくはキット添付の取扱説明書でご確認ください。
4.13,000~17,000xgで10~20分間遠心します。
5.上清を回収し、1/5容量のSolution 2-2(キット添付)を添加し、室温で10分間反応します(還元アルキル化処理)。
※還元アルキル化処理は必須ではありません。
参考データ:2次元電気泳動
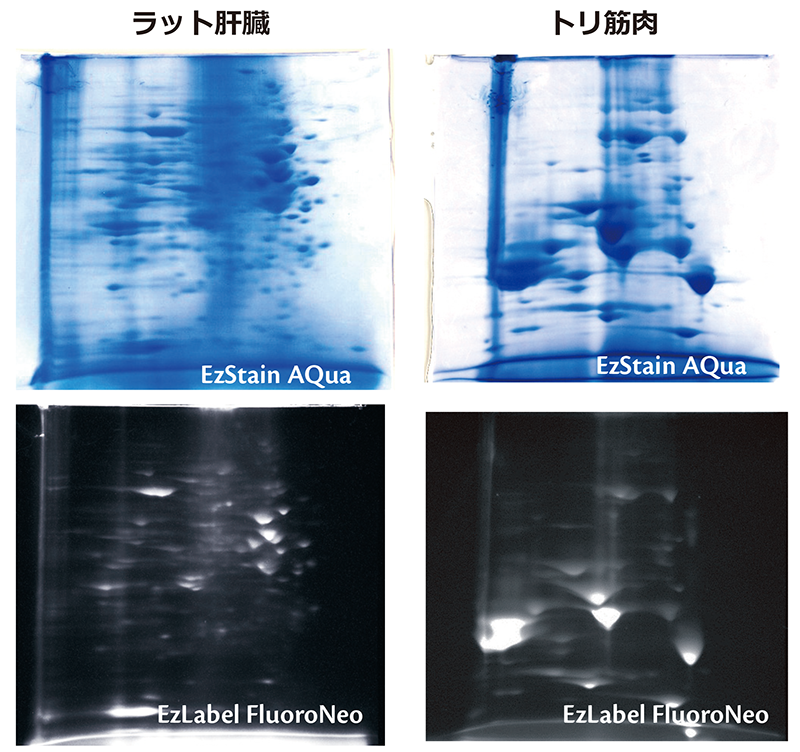
ラット肝臓タンパク質およびトリ筋肉からEzApply 2D kitを使用してタンパク質を抽出し、agarGEL(A-M310)を使用して一次元目の等電点電気泳動を行いました。上記写真のうち上段は一次元目のゲルを通常の方法でSDS平衡化処理し、下段はSDS平衡化処理する際にEzLabel FluoroNeoの1x Sample buffer (Labeling reagent添加済み、DTT非添加)で30分間、さらにDTT添加1x Sample bufferで10分間処理しました。2次元目の電気泳動はePAGEL (E-D520L)を使用して分離しました。上段は泳動後のゲルをEzStain AQuaで染色した結果を示しています。また下段は泳動後のゲルをBlue LEDで励起し、540LPフィルターを使用して撮影した結果を示しています。一次元目の分離にアガロースを担体とするゲルを使用しているため、大量のタンパク質をアプライして分離することができ、また高分子タンパク質も解析可能なことが判ります。
参考
Native PAGE用サンプルの調製
Native PAGEはタンパク質を変性させずに電気泳動で分離する方法です。タンパク質のコンプレックス、立体構造、分子量、電荷のすべてが影響するため、シャープなバンドパターンを得ることは困難です。そこで、サンプルを尿素処理などによりリニアライズしたり、Blue-Native PAGEのようにサンプルバッファーや泳動バッファーに若干電荷を付加して泳動する方法もあります。分離する目的タンパク質の電荷(等電点)に合わせて、Tris-Glycine (pH8.3~9.5)やTris-borate (pH7.0~8.5) 、 Tris-acetate (pH7.2~8.5)などの泳動バッファーを陰極側と陽極側で組み合わせて分離します。
調製方法
1.45μLのサンプルに5μLのEzApply Native(10x)を加えて混合します。
2.サンプルは加熱処理はしません。目的タンパク質の等電点に合わせて、泳動バッファーを陰極と陽極で組み合わせて使用します。また電気泳動は低温でゆっくり泳動します。
主な電気泳動サンプル調製試薬の組成
電気泳動サンプル調製で使用する主な試薬の組成です。より再現性良く、簡便に実験を行う際はパジェルなどの既製ゲルやアトー試薬をご利用ください。
- SDSサンプルバッファー(5x): 250mM Tris-HCl (pH6.8)、8% SDS、0.1% Bromophenol blue、40% Glycerol、100 mM DTT
- Nativeサンプルバッファー(5x): 250mM Tris-HCl (pH6.8)、0.1% Bromophenol blue、40% Glycerol
- 等電点電気泳動タンパク質の抽出液(O'Farrell 法)
- 9.5 M Urea, 2% NP-40, 1.6% Ampholine 5-7, 0.4% Amphjoline 3-10, 5% β-Mercaptoethanol / 10 mL