テクニカルインフォメーション
ウエスタンブロッティング 抗体反応と検出
ウェスタンブロッティングでは、ターゲットタンパク質のバンドを抗体でプロービングし、さらに酵素や蛍光などを介して検出します。抗体反応は抗体の希釈率、反応時間や温度によって、また検出は発光・発色・蛍光などの検出方法および酵素の基質の種類によって、検出感度とシグナル強度が影響され、実験結果が大きく異なります。今回はアトーの製品を使用した抗体反応~検出に関してご紹介します。
実験の流れ
1.サンプル調製
細胞や組織などからRIPA Lysisバッファー やSDSサンプルバッファーでタンパク質を抽出し、SDS処理および還元処理を行います。
使用する製品
タンパク質抽出処理液
(EzRIPA Lysis kit, EzApply, EzLabel FluoroNeo)
ブロックインキュベータ
(MyMiniBLOCK, PowerBLOCK)
3.トランスファー
電気泳動で分離したタンパク質をゲルからPVDF膜に転写します。
使用する製品
トランスファーバッファー
(EzFastBlot HMW, EzFastBlot)
ブロッターパワーサプライ
(PoweredBLOT 2M)
実験方法
電気泳動~ブロッキング
高分子の場合… |
低分子の場合… |
|
| 電気泳動 | できるだけ低濃度のアクリルアミドを使用します。7.5%以下の濃度のアクリルアミドゲルは取り扱いが難しいため、その場合は濃度勾配ゲルを使用します。 | 低分子バンドの分離に適した高濃度アクリルアミドゲルは転写効率が著しく下がります。電気泳動バッファーEzRun MOPSを使用すると、10%前後のアクリルアミドゲルでも低分子側のバンドが分離でき、且つアクリルアミド濃度が均一のため、ブロッティング前後でのゲルの変形も防ぐとともに、高効率に転写することが可能になります。 |
| トランスファー | 150kDa以上の高分子は転写効率が著しく悪いため、高分子専用のトランスファーバッファーであるEzFastBlot HMWを用いたセミドライブロッティング、もしくはタンク式ブロッターを使用します。また転写前にゲルをトランスファーバッファーで平衡化(約30分間)するとタンパク質の転写効率が上がる場合があります。ただし平衡化の時間が長くなると低分子バンドが消失したりバンドが拡散するので注意が必要です。 | 低分子タンパク質(~200kDa)を転写する場合、EzFastBlotを使用すると約10分間の短時間で、高効率に転写することができます。低分子の場合、ブロッティング膜から抜ける場合がありますので、ポアサイズが0.2μmのPVDF膜(P plus膜)を使用します。またトランスファーバッファーにメタノールを添加すると膜への吸着がよくなります(EzFastBlotシリーズにはメタノールを添加しないでください)。 |
| ブロッキング | 目的タンパク質に合わせてブロッキング剤を選択します。ブロッキング剤の濃度が高かったり反応時間が長くなるとオーバーブロックになり、検出感度が悪くなります。逆に短すぎると十分にブロッキングされず、バックグランドが上がったり、非特異的バンドが出現する要因になります。 | 目的タンパク質に合わせてブロッキング剤を選択します。ブロッキング剤の濃度が高かったり反応時間が長くなるとオーバーブロックになり、検出感度が悪くなります。逆に短すぎると十分にブロッキングされず、バックグランドが上がったり、非特異的バンドが出現する要因になります |
抗体反応と検出の準備
ブロッキングをしている間に抗体の準備をします。
洗浄液
ミニゲル1枚当たり500mL準備します。
- TBS-T:EzTween(あるいは0.01~0.1%Tween 20)含有1×EzTBS (あるいは50 mM Tris, 137 mM NaCl, 2.7 mM KCl/pH7.4)
- PBS-T:EzTween(あるいは0.01~0.1%Tween 20)含有1×EzPBS (あるいは137 mM NaCl, 2.7 mM KCl, 81 mM Na2HPO4, 14.7 mM KH2PO4)
※リン酸化タンパク質を検出する際は、なるべくTBS-Tを使用します。
抗体
一般的にターゲットタンパク質に対する1次抗体と検出用の酵素や蛍光が標識された2次抗体を準備します。
1次抗体が直接標識されている場合は2次抗体は不要です。
抗体の希釈率は抗体や検出試薬の添付文書を参考にして決めます。
サンプルや時間に余裕がある場合は、ドットブロッティングで適切な抗原の検出感度になるように希釈率を検討します。
また抗体の希釈は抗体反応の直前に行います。
抗体を希釈した状態で長時間置くと失活する場合があります。
抗体の選択方法
1次抗体
抗原(Antigen)、交差種(Cross reactivity)、免疫動物(host)、用途(WB, IP, ICC,,,)およびアプリケーションデータなどを参考にして、実験の目的に合うものを選択します。
2次抗体を介さずに検出する場合は標識されている抗体を選択します。
(例)ウェスタンブロッティング用のヒトトランスフェリン抗体(Anti-HumanTransferrin Rabbit Poly 抗原:ヒトトランスフェリン 免疫動物:ウサギ など)
- 抗原:(ヒト)トランスフェリン(他ペプチド、発現タンパク質等)
- 交差種:ヒト、マウス、ラット(必ずヒトが含まれるもの)
- 免疫動物:ウサギ(他マウス、ヤギ等)
- 用途:WB、EIA、IP(必ずWBが含まれるもの)
2次抗体
1次抗体と同様ですが、検出方法に適した標識(HRP, ALP, Rhodamin,,,)がされているものを選択します。
(例)上記の1次抗体に対する2次抗体Goat (Anti-Rabbit IgG H&L (HRP) 抗原:ウサギIgG(重鎖軽鎖) 免疫動物:ヤギ 標識:HRPなど)
- 抗原:ウサギIgG(1次抗体の免疫動物の抗体。1次抗体がモノクローナル抗体の場合は抗体のアイソタイプ(IgG, IgA, IgM等)に注意し、またFab断片化されている場合には重鎖(Fc)のみを認識する抗体は除外するように選択します)
- 交差種:なし(できるだけ交差種がないもの)
- 免疫動物:ヤギ(1次抗体の免疫動物であるウサギ、及びターゲットタンパク質であるヒトが含まれていないもの*)
- 用途:WB、EIA、IP(必ずWBが含まれるもの)
- 標識:HRP(一般的に発光検出する場合はHRPかALP)
* 抗原がヒトの場合
検出試薬
蛍光色素でラベルされた抗体を使用した場合は、検出試薬は不要です。各蛍光色素に適した励起光を使用し、励起した特定波長の蛍光をフィルター等で分離して取得します。
ALP(アルカリホスファターゼ)やHRP(西洋わさびペルオキシダーゼ)などの酵素でラベルされた抗体を使用した場合は、それぞれの酵素の基質からなる検出試薬を使用してシグナルを取得します。
アトーでは下記3種類のHRPに対する検出試薬を販売しています。
| HRP検出試薬 | EzWestBlue W | EzWestLumiOne | EzWestLumi plus |
|---|---|---|---|
| 型式 | WSE-7140 | WSE-7110 | WSE-7120 |
| 検出方法 | TMBによる呈色 | Luminolによる発光 | Luminolによる発光 |
| 使用方法 | PVDF膜を溶液に浸漬して10~30分 | PVDF膜を溶液に浸漬してすぐに検出 | 使用直前にA液とB液を等量混合する |
| 検出感度 | pg低域 | pg低域 | fg中域 |
| 発光持続時間 | ー | 1時間< | 3時間< |
抗体反応と検出方法
下記に従って抗体反応~検出反応および撮影をします。
1.1次抗体の反応
2.洗浄

3.2次抗体の反応
4.洗浄

5.検出反応
 |
検出直前に検出試薬を計量、混合などの調整を行います。清潔なラップあるいは容器に調整した検出用液を全量注ぎます。ブロッティング膜(PVDF膜)をピンセット等でつまみ上げ、余分なTBS-T/PBS-Tをペーパータオル等で完全に除去します。ブロッティング膜を検出試薬に浸漬します。その際、空気が入らないように気を付け、素早く、均一に検出試薬が膜に広がるようにします。膜の表と裏に検出試薬が十分浸透されることを確かめます。発色検出の場合は、十分に発色されるまで反応し、その後蒸留水ですすいでから、シグナルを撮影します。発光検出の場合は、膜をラップやフィルムシートに密閉し、撮影装置で撮影します。 |
6.撮影
高感度発光/蛍光撮影装置を使用して発光あるいは蛍光シグナルを撮影します。
発光を撮影する場合
絞りは全開にセットし、フィルター等は使用しません。密閉したブロッティング膜を撮影区域の中央に置き、ピントを合わせます。
撮影モード(Standard、Highなど)を選択し、撮影時間(5秒、1分、5分など)を設定して撮影します。
有色マーカーを使用したときはマージ像を得るために明視野も撮影します。
蛍光を撮影する場合
標識蛍光色素に適した励起光を使用し、蛍光の取得に適したフィルターを使用します。
密閉したブロッティング膜を撮影区域の中央に置き、励起光を点灯した状態でピントを合わせて撮影します。
実験データ
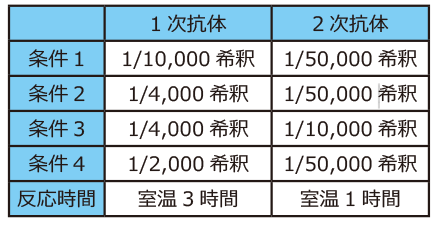
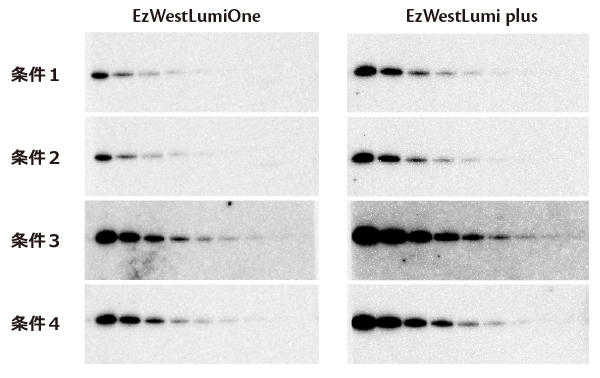
実験例1:抗体の希釈濃度の影響
 |
|
上図は200 pg/レーン~1/2希釈したヒトトランスフェリンを電気泳動し、ヒトトランスフェリン抗体およびHRP標識2次抗体で検出した結果です。
1次抗体および2次抗体の希釈率を右表のように変えて反応し、EzWestLumiOneあるいはEzWestLumi plusでバンドを検出した結果です。
条件2に比べて条件1は一次抗体濃度が半分以下ですが、結果はほとんど変わりません。
逆に、条件2と3は一次抗体濃度は同じですが、2次抗体濃度が5倍であり、これらを比較すると条件3はシグナル強度も検出感度もはるかに優れていることが判ります。
また条件1と4は2次抗体濃度は同じですが、1次抗体濃度が5倍です。
検出感度は一次抗体濃度が高い方が高くなりますが、シグナルは弱いままです。
このように同じタンパク質量を泳動して転写したブロッティング膜を使用しても、1次抗体と2次抗体の濃度によって検出感度やシグナル強度が大きく異なることが示されました。
もちろん検出試薬によっても検出感度は異なりますが、検出試薬だけではなく抗体濃度の検討も重要であることが判ります。
実験例2:検出感度と持続時間
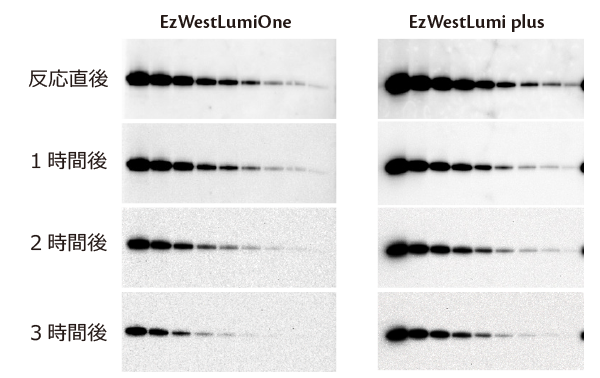
上図は500 pg/レーン~1/2希釈したヒトトランスフェリンを電気泳動し、転写したブロッティング膜を1/4,000希釈したヒトトランスフェリン抗体および1/10,000希釈したHRP標識2次抗体と反応し、
EzWestLumiOneあるいはEzWestLumi plusでバンドを検出した結果です。
上記の結果のようにEzWestLumiOneは1時間以上シグナルが安定であり、またEzWestLumi plusは発光強度は若干下がりますが3時間まで安定にシグナルを検出できることが示されました。