テクニカルインフォメーション
ウエスタンブロッティング トランスファー(転写)
ウェスタンブロッティングのトランスファー(転写)はゲル中で分離されたタンパク質を電気的にゲルから引っ張りだしてメンブレン(膜)へと写す工程です。いわば電気泳動ゲルのコピーを作成するような感じです。作業自体は簡単なのですが、膜へトランスファーする際にムラになったり(ゲルと膜が密着していない)、空気が入って穴抜けになったりすることがあり、満足のできる転写膜(ブロッティング膜)を得ることは、熟練した研究者でもなかなか難しいと聞きます。今回はアトーの製品を使用したウェスタンブロッティングのセミドライ式トランスファーに関してご紹介します。
実験の流れ
1.サンプル調製
細胞や組織などからRIPA Lysisバッファー やSDSサンプルバッファーでタンパク質を抽出し、SDS処理および還元処理を行います。
使用する製品
タンパク質抽出処理液
(EzRIPA Lysis kit, EzApply, EzLabel FluoroNeo)
ブロックインキュベータ
(MyMiniBLOCK, PowerBLOCK)
3.トランスファー
電気泳動で分離したタンパク質をゲルからPVDF膜にトランスファーします。
使用する製品
トランスファーバッファー
(EzFastBlot HMW)
トランスファーパック
(QBlotシリーズ)
ブロッターパワーサプライ
(HorizeBLOT)
実験方法
電気泳動
目的タンパク質が中央部分にくるように、ゲルのアクリルアミド濃度を選択します。アイソフォームやリン酸化など僅差の移動度をもつ複数のタンパク質バンドを検出する際は、それぞれのタンパク質が分離できるアクリルアミド濃度もしくは濃度勾配ゲルなどを使用します。ゲルのアクリルアミド濃度が低い場合は、電気泳動後のゲルが柔らかく、ブロッティング操作で取り扱いが難しくなります。またゲルのアクリルアミド濃度が高い場合には、転写効率が下がります。特に13%以上のゲルを使用する際は、トランスファーバッファー中にメタノールが含まれると転写効率が下がるため、メタノール濃度を低くする、もしくは入れないようにします。
高分子の場合… |
低分子の場合… |
||
|---|---|---|---|
| できるだけ低濃度のアクリルアミドを使用します。ただし7.5%以下の濃度のアクリルアミドゲルは取り扱いが難しいため、その場合は濃度勾配ゲルを使用します。150kDa以上の高分子は転写効率が著しく悪いため、高分子専用のトランスファーバッファーであるEzFastBlot HMWを用いたセミドライブロッティング、もしくはタンク式ブロッターを使用します。またトランスファー前にゲルをトランスファーバッファーで平衡化(約30分間)するとタンパク質の転写効率が上がる場合があります。ただし平衡化の時間が長くなると低分子バンドが消失したりバンドが拡散するので注意が必要です。 | 一般的には高濃度のアクリルアミドゲルを使用しますが、転写効率が著しく下がります。そこで、10%前後のアクリルアミドゲルと低分子側のバンドが分離できる泳動バッファーEzRun MOPSを使用してバンドを分離します。アクリルアミド濃度が均一のためゲルの変形が防げるとともに、高効率にトランスファーすることが可能になります。 |
トランスファーの準備
電気泳動を行っている間にトランスファーの準備をします。
ブロッティング溶液
ミニゲル1枚当たり200mL準備します。下表を参照して目的分子の分子量、転写時間などからブロッティングバッファーを選択します。
| 製品名 | EzBlot | EzFastBlot | EzFastBlot HMW | EzRun TG(Towbin法) |
|---|---|---|---|---|
| 型式 | AE-1460 | AE-1465 | WSE-7210 | WSE-7055 |
| 主成分 | 3液法(不連続) A: トリス B: トリス C: トリス、6-アミノカプロン酸 A~C: +MeOH (5%) |
1液法(連続) トリス アミノ酸 MeOH不含 |
1液法(連続) トリス MeOH不含 |
1液法(連続) 25mM トリス、192mMグリシン, ~10% MeOH(終濃度) |
| 転写可能分子 | ~300kDa | ~200kDa | ~600kDa | ~200kDa |
| 転写条件 | 2mA/cm2 60 min |
20~25V c.v. 5~15 min |
25V c.v. 15~30 min |
2mA/cm2 60 min |
| 使用方法 | MeOHを添加する | 蒸留水で10倍希釈 | 蒸留水で5倍希釈 | 蒸留水で10倍希釈 |
| 特徴 | 広範囲の分子量をシャープなバンドでキレイにトランスファー | 約10分で200 kDa 以下の分子を高効率にトランスファー | 30分以内に200 kDaの高分子も効率よくトランスファー | 主にタンク式で使用 (せミドライ式では低効率) |
※メタノールは膜へのタンパク質結合効率を上げられます。PVDF膜≦15%、ニトロセルロース膜≦20%で使用します。
※高分子タンパク質の場合、0.01~0.05%SDSを添加すると転写効率が上がる場合があります。
※トランスファー前に泳動後のゲルをトランスファーバッファーで15~30分間平衡化すると転写効率が上がる場合があります。
ただしバンドが拡散したり、低分子バンドが消失する場合がありますのでご注意ください。
PVDF膜
※ポアサイズが0.2μmの膜をご使用ください。低分子の場合、ポアサイズが大きいと膜から通り抜ける場合があります。
1.直接手を触れないように清潔な手袋を着用し、ゲルサイズにカットします。
ミニゲルサイズ:8.5×9 cm
コンパクトゲルサイズ:6.5×6.5 cm
アトー製品:WSE-4050~4053クリアブロット・Pプラス膜シリーズ
2.100%メタノール液に浸漬して親水化します(10秒以上)。
3.ブロッティング溶液に浸漬して10~30分平衡化します。
ろ紙
※トータルの厚みが4~6㎜になるように枚数を調整してください。
※長時間浸漬すると、ろ紙が溶ける場合があります。
1.直接手を触れないように清潔な手袋を着用し、ゲルサイズにカットします。
ミニゲルサイズ: 8.5×9 cm
コンパクトゲルサイズ: 6.5×6.5 cm
アトー製品:CB-06A,09A,13A,20Aアブソーベントペーパーシリーズ
2.トランスファーの直前にブロッティング溶液に浸漬します(10秒以上)。
ブロッキング溶液
ミニゲル1枚当たり50mL準備します。BSAやカゼインなどのタンパク質由来のものと合成ポリマーなどからなる非タンパク質性のものがあります。
一般的にタンパク質由来のブロッキング溶液は0.5~5%濃度でTBS-TやPBS-Tに溶解して使用します。
洗浄液
ミニゲル1枚当たり500mL準備します。
| TBS-T | PBS-T | ||
|---|---|---|---|
| EzTween(あるいは0.01~0.1%Tween 20)含有1×EzTBS (あるいは50 mM Tris, 137 mM NaCl, 2.7 mM KCl/pH7.4) | EzTween(あるいは0.01~0.1%Tween 20)含有1×EzPBS (あるいは137 mM NaCl, 2.7 mM KCl, 81 mM Na2HPO4, 14.7 mM KH2PO4 ※リン酸化タンパク質を検出する際は、なるべくTBS-Tを使用します。 |
抗体
ミニゲル1枚当たり5~20mL準備します。一般的にターゲットタンパク質に対する1次抗体と検出用の酵素や蛍光が標識された2次抗体を準備します。
1次抗体が直接標識されている場合は2次抗体は不要です。抗体の希釈率は抗体や検出試薬の添付文書を参考にして決めます。
サンプルや時間に余裕がある場合は、ドットブロッティングで適切な抗原の検出感度になるように希釈率を検討します。
また抗体の希釈は抗体反応の直前に行います。
抗体を希釈した状態で長時間置くと失活する場合があります。
ブロッターのセッティング
下記に従ってブロッターをセットします。
1.膜の平衡化

2.ゲルの洗浄

高分子タンパク質をトランスファーする場合、15分以上浸漬すると転写効率が上がる場合があります。
3.ろ紙の浸漬
また長時間浸漬すると、ろ紙が溶ける場合があります。
4.ろ紙

ろ紙の上にトランスファーバッファーを2~3mL滴下します。
5.PVDF膜

トランスファーバッファーの上に浮いた状態にすると、ろ紙の上に膜を重ねて置きやすくなります。膜の上にトランスファーバッファーを2~3mL 滴下します。
6.ゲル

トランスファーバッファーの上で浮いた状態にすることで、ゲルを動かすことができ、PVDF 膜の上にゲルをピッタリ重ねて置きやすくなります。
7.ろ紙

ろ紙をさらに2~3 枚重ねておきます。ろ紙とゲルと膜のサンドイッチがずれないようにしっかり片手で押さえ、もう片方の手で軽く押した状態でローラーを転がし、
空気と余分なトランスファーバッファーを除去します(写真参照)。電極板を傾け、電極板上の余分なトランスファーバッファーを除去します。

また空気が除去されないと穴抜けの原因になります。ローラーはサンドイッチの端で止めずに、転がし切るようにしてください。ローラーは泳動方向に対して垂直にかけてください。
8.トランスファーの開始

陰極側の電極板を載せて、ブロッティング装置をセットし、電源につないで通電し、トランスファーを開始します。
陰極側(上部)にゲル、陽極側(下部)にPVDF 膜がくるように重ねます。タンパク質は負電荷を帯びているため、陽極側に移動してトランスファーされます。
※トランスファーパックQBlot kit シリーズはろ紙や膜の準備が不要です(Ready to use)。
専用ブロッティングバッファーにより転写効率も高く、短時間で高効率のウエスタンブロッティングが可能です。
ブロッティング
1.ブロッターと電源を接続します。
2.下表を参考にして電流/ 電圧条件をセットし、通電します。
| 製品名 | EzBlot | EzFastBlot | EzFastBlot HMW | EzRun TG(Towbin法) |
|---|---|---|---|---|
| 型式 | AE-1460 | AE-1465 | WSE-7210 | WSE-7055 |
| 転写条件 | 2mA/cm2 60 min (~40V) |
20~25V c.v. 5~15 min (500mA/gel) |
25V c.v. 15~30 min (500mA/gel) |
2mA/cm2 60 min (~40V) |
ブロッティング終了後の操作
1.電源をオフにし、ブロッターから電源を外します。
2.ブロッターの上部電極板を外し、ろ紙を除去して、ブロッティング膜をピンセットを使って回収します。
※ゲルはCBB 染色液で染色します(オプション)。ゲルに残っているバンドをEzStain AQuaで染色することで、転写効率や転写ムラを確認することができます。
※ブロッティングした膜をEzStainAQua MEMで染色することで、転写効率や転写ムラを確認することができます。脱色後は抗体反応が可能です。
3.TBS-T でブロッティング膜を洗浄します。
※洗浄後のブロッティング膜は風乾した後に密閉し、- 20℃で保存可能です。保存期間は抗原の安定性に依存しますが、通常は1 か月程度です。
保存後のブロッティング膜は100% メタノールに浸漬して素早く親水化し、TBS-T で洗浄した後に、ブロッキング以降の反応を通常通り行います。
4.ブロッキング溶液に浸漬し、ブロッキング反応を行います。
5.抗体反応を行い、検出試薬でシグナルを検出します。
参考データ
実験例:転写バッファーによる違い
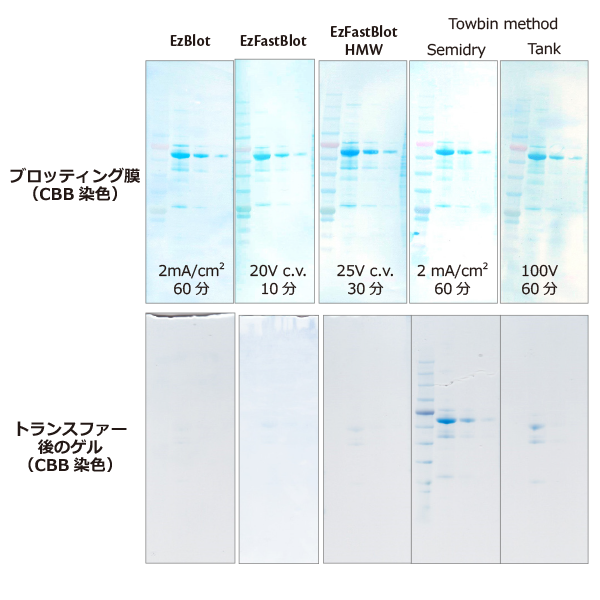
様々なトランスファーバッファーを用いてブロッティングを行った後のブロッティング膜とゲルをEzStain AQua (CBB)で染色した結果です。
従来のTowbin 法によるトランスファーバッファーよりもEzBlot、EzFastBlot、EzFastBlot HMW はセミドライ式でも高効率にタンパク質バンドをトランスファーできます。
EzFastBlotは約10 分の短時間で~200kDa までのタンパク質をトランスファーするのに適しており、EzFastBlot HMW は200kDa 以上の高分子タンパク質も約30 分間という短時間で、
タンク式のブロッティングと同等以上の効率でトランスファーできます。またEzBlot はタンパク質をシャープなバンドで明瞭にトランスファーするのに適しています。
資料ダウンロード
動画で紹介
ウエスタンブロッティングの操作方法
QBlot kitの使用方法