テクニカルインフォメーション
ウエスタンブロッティングの基本操作
ウェスタンブロッティングはタンパク質サンプル中に含まれる特定のタンパク質の発現量を確かめるために使われる一般的な手法です。実験操作は簡単ですが、なかなか思うようなデータを取ることができないといった経験を持つ方は多いのではないでしょうか。今回はアトーの製品を使用したウェスタンブロッティングの基本操作に関してご紹介します。
実験の流れ
1.サンプル調製
細胞や組織などからRIPA Lysisバッファー やSDSサンプルバッファーでタンパク質を抽出し、SDS処理および還元処理を行います。
使用する製品
タンパク質抽出処理液
(EzRIPA Lysis kit, EzApply, EzLabel FluoroNeo)
ブロックインキュベータ
(MyMiniBLOCK, PowerBLOCK)
3.トランスファー
電気泳動で分離したタンパク質をゲルからPVDF膜に転写します。
使用する製品
トランスファーバッファー
(EzFastBlot HMW, EzFastBlot)
ブロッターパワーサプライ
(PoweredBLOT 2M)
機器・試薬・材料
- 細胞・組織サンプル等(例:Hela細胞)
- EzRIPA Lysis kit, EzApply, EzLabel FluoroNeo・・・タンパク質抽出・処理液
- e-PAGEL HR ・・・プレキャストゲル
- EzRun, EzRun MOPS ・・・電極液
- WSE-4050~4053クリアブロット・Pプラス膜シリーズ・・・PVDF膜
- CB-06A,09A,13A,20Aアブソーベントペーパーシリーズ・・・ろ紙
- EzTBS・・・洗浄液(Tris buffer saline)
- EzTween・・・洗浄液に添加する界面活性剤
- EzFastBlot HMW, EzFastBlot・・・トランスファーバッファー
- EzBlockChemi・・・ブロッキング剤
- EzWestLumi plus・・・HRP発光基質
- MyMiniBLOCK, PowerBLOCK・・・ヒートブロックインキュベータ
- Rapidus Mini slab、PageRunAce・・・電気泳動槽
- PowerStation Ghibli I, MyPower II・・・パワーサプライ
- PoweredBLOT 2M・・・セミドライブロッター
- Luminograph I/II/III・・・発光撮影装置
- 一次抗体(例:抗ヒトトランスフェリン-ウサギ抗体)
- HRP標識2次抗体(例:HRP標識抗ウサギIg抗体)
- ピンセット、トレイ(ゲルサイズより一回り大きいもの)
- シーソーシェーカー atto・・・シーソーシェーカー
実験方法
サンプル調製
1.50μLのサンプルに50μLのEzApply (2×濃度、DTT添加済み)を加えて混合します。
2.MyMiniBlockで95℃5分間加熱します(煮沸でもOK)。
3.15,000rpmで5分間遠心し(しなくてもOK)上清を回収します。
電気泳動
1.e-PAGEL-HR(プレキャストゲル)をパジェランAce(電源付電気泳動装置)にセットします。
2.1レーンあたり5~10μLのサンプルをアプライします。
※サンプル濃度は精製タンパク質では100ng~1μg/lane、抽出液では1~50μg/laneが適当です。
3.スタートボタンを押して電気泳動を開始します。
※High mode (24W)で35分、もしくはStandard mode (20mA/gel)で約80分間泳動します。
トランスファー
1.あらかじめP plus膜をメタノールで浸水化処理し(5秒)、EzFastBlotに浸漬しておきます(15分以上振とうします)。
2.電気泳動後のゲルをEzFastBlotで洗浄し、下図のように陽極側(下)からろ紙2枚、P plus膜、ゲル、ろ紙2枚の順に重ねます。ろ紙は重ねる直前にEzFastBlotに浸漬します。
※空気を専用ローラーを使って押し出し、ろ紙、膜、ゲルを密着します。
3.スタートボタンを押してトランスファーを開始します。
※Rapid mode (20~25V/gel)で10~15分通電します。

※ローラーで軽く押さえて密着させます。このとき、ローラーは端で止めずに転がし切ると空気が抜けます。
※陰極側(上部)にゲル、陽極側(下部)にPVDF膜がくるように重ねます。タンパク質は負電荷を帯びているため、陽極側に移動して転写されます。
アトーのブロッティング溶液
| 製品名 | EzBlot | EzFastBlot | EzFastBlot HMW | EzRun TG(Towbin法) |
|---|---|---|---|---|
| 型式 | AE-1460 | AE-1465 | WSE-7210 | WSE-7055 |
| 主成分 | 3液法(不連続) A: トリス B: トリス C: トリス、6-アミノカプロン酸 A~C:+MeOH (5%) |
1液法(連続) トリス アミノ酸 MeOH不含 |
1液法(連続) トリス MeOH不含 |
1液法(連続) 25mM トリス、192mMグリシン, ~10% MeOH(終濃度) |
| 転写可能分子 | ~300kDa | ~200kDa | ~600kDa | ~200kDa |
| 転写条件 | 2mA/cm2 60 min |
20~25V c.v. 5~15 min |
25V c.v. 15~30 min |
2mA/cm2 60 min |
| 使用方法 | MeOHを添加する | 蒸留水で10倍希釈 | 蒸留水で5倍希釈 | 蒸留水で10倍希釈 |
| 特徴 | 広範囲の分子量をシャープなバンドでキレイにトランスファー | 約10分で200kDa 以下の分子を高効率にトランスファー | 30分以内に200kDaの高分子も効率よくトランスファー |
主にタンク式で使用 |
※メタノールは膜へのタンパク質結合効率を上げることが出来ますが、ゲルからの移行率が低下しますのでご注意ください。PVDF膜≦15%、ニトロセルロース膜≦20%で使用します。
※高分子タンパク質の場合、0.01~0.05%SDSを添加すると転写効率が上がる場合があります。
※トランスファー前に泳動後のゲルをトランスファーバッファーで15~30分間平衡化すると転写効率が上がる場合があります。
ただしバンドが拡散したり、低分子バンドが消失する場合がありますのでご注意ください。
※トランスファーパックQBlot kit C/M/Wはろ紙や膜の準備が不要です(Ready to use)。
専用ブロッティングバッファーにより転写効率も高く、短時間で高効率のウエスタンブロッティングが可能です。
※ブロッティングした膜はEzStainAQua MEMで染色することでバンドを確認できます。脱色後は抗原抗体反応(特異的検出)が可能です。
ブロッキング
トランスファー後のP plus膜をブロッキング剤に浸漬し、室温で30分振とうします。ミニゲル1枚当たり50mL準備します。
アトーのブロッキング溶液
| ブロッキング剤 | スキムミルク | EzBlock Chemi | EzBlock BSA | EzBlock CAS |
|---|---|---|---|---|
| 型式 | ― | AE-1475 | AE-1476 | AE-1477 |
| 主成分 | 牛スキムミルク | 合成ポリマー | 牛アルブミン | 牛カゼイン |
| 反応時間 | 30~60min | 5~60min | 15~60min | 15~60min |
| アビジンービオチン | NG | OK | OK | NG |
| リン酸化タンパク質 | NG | OK | OK | NG |
※スキムミルクは3%前後の濃度でTBS-Tに混合して使用します。
※EzReprobeを使用する場合はEzBlock CASの使用を推奨します。
抗体反応
1.一次抗体を0.1% Tween含有のEzTBS(TBS-T)もしくはEzPBSで希釈します(10mL/gel)。
※抗体の希釈率は抗体によって異なります。各抗体に添付された取扱説明書をご参考ください。一般的には数百~数千倍希釈です。
2.P plus膜よりも一回り大きい容器に①の抗体溶液を入れ、室温で1時間振とうしながらP plus膜と反応します。
※抗体の反応時間と温度は抗体によって異なります。各抗体に添付された取扱説明書をご参考ください。一般的には室温および37度で30分~1時間、もしくは4℃で一晩反応します。
3.抗体を捨てて0.1% Tween含有EzTBS(TBS-T)を50mL 添加し、5分間振とうします(洗浄操作)。洗浄操作は3回以上繰り返して行います。
4.HRP標識二次抗体を0.1% Tween含有のEzTBS(TBS-T)もしくはEzPBSで希釈します(10mL/gel)。
※抗体の希釈率は抗体によって異なります。各抗体に添付された取扱説明書をご参考ください。一般的には数千~数万倍希釈です。
※バックグランドが高い場合は抗体の希釈率を上げる、もしくは抗体希釈溶液にブロッキング剤を通常の1/10量添加すると軽減されます。
5.洗浄後のP plus膜に④の抗体を添加し、室温で30分間振とうしながら反応します。
※抗体の反応時間と温度は抗体によって異なります。各抗体に添付された取扱説明書をご参考ください。一般的には室温で30分~1時間、もしくは4℃で一晩反応します。
6.抗体を捨てて0.1% Tween含有EzTBS(TBS-T)を50mL 添加し、5分間振とうします(洗浄操作)。洗浄操作は3回以上繰り返して行います。
※洗浄しすぎるとシグナルが弱くなる場合があります。
検出
1.検出方法および目的の検出感度に合わせてHRP検出試薬を選択します(下表参照)。
2.PVDF膜をHRP検出試薬に浸漬して反応します。
| HRP検出試薬 | EzWestBlue W | EzWestLumiOne | EzWestLumi plus |
|---|---|---|---|
| 型式 | WSE-7140 | WSE-7110 | WSE-7120 |
| 検出方法 | TMBによる呈色 | Luminolによる発光 | Luminolによる発光 |
| 使用方法 | PVDF膜を溶液に浸漬して5~30分 | PVDF膜を溶液に浸漬してすぐに検出 | 使用直前にA液とB液を等量混合する |
| 検出感度 | pg低域 | pg低域 | fg中域 |
| 発光持続時間 | ー | 1時間< | 3時間< |
※EzWestBlue Wを使用する場合、PVDF膜と5~30分間、遮光しながら反応し、スキャナー等でスキャンしてデータを記録します。
※EzWestLumiOneはPVDF膜を浸漬した後、すぐに発光撮影装置で撮影し、データを取得してください。
※EzWestLumi plusはReagent AとReagent B を1:1の等量で混合し、PVDF膜を浸漬した後、すぐに発光撮影装置で撮影し、データを取得してください。
※検出試薬の使用量は100~200μL/cm2 です。ミニゲルサイズの場合、5mL以上準備してください。
ストリッピング
1.検出反応後のブロッティング膜は、0.1% Tween含有EzTBS(TBS-T)でリンスした後、ストリッピングを行うまでTBS-T中で冷蔵保存してください。
2.100mLのEzReprobeに対して、0.6gのEnhancerを添加して溶解します。
3.ブロッティング膜をEzReprobeに浸漬し、室温で5~15分間振とうします。
※抗原量が多い場合や抗体のタイターが高い場合には反応時間の延長する、もしくは反応温度を上げるとストリッピング効率が向上します。
4.EzReprobeを廃液し、EzTBS(Tween 20含有)等の洗浄液を数mL加えて容器の内壁を軽くすすぎます。
5.約30mLのTween 20 含有EzTBSを注ぎ 3分間振とうします。
6.ブロッティング膜をEzBlock CAS等のブロッキング溶液でブロッキングします。
7.新たな一次抗体、二次抗体を順次反応させます。
参考データ
実験例:EzReprobeとブロッキング試薬
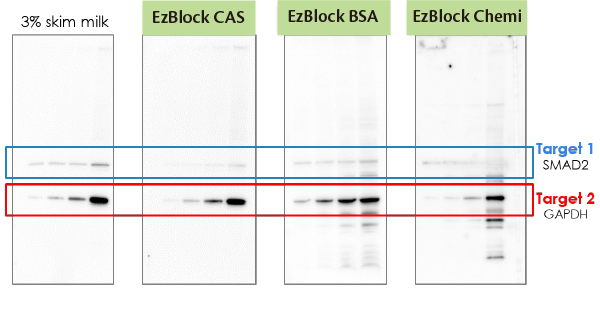
上図の実験はEzReprobeとブロッキング剤の影響を検討した結果を示しています。
まずHela細胞からEzRIPA Lysis kitにより抽出した細胞抽出液をEzApplyと混合し、MyMiniBlockを用いて95度で10分間反応して泳動サンプルとしました。
サンプルを段階希釈して10%ePAGELゲルで泳動分離し、EzFastBlotでP plus膜に20V定電圧で10分間転写しました。
その後、EzBlockChemiで30分間ブロッキングし、抗SMADラビットモノクローナル抗体と反応して、EzWestLumi plusでシグナルを検出しました。
発光イメージをLuminographで撮影後、EzReprobeと室温で10分間反応してストリッピングし、図示した各ブロッキング剤で15分間ブロッキングしました。
抗GAPDHラビットポリクローナル抗体で反応した後、EzWestLumi plusでシグナルを検出し、Luminographで撮影しました。
上図の結果のように、EzReprobeでストリッピングした後はEzBlockCASでブロッキングすると、バックグランドが低く抑えられ、
非特異的なバンドが検出されず、きれいなデータが得られることが示されました。
資料ダウンロード
動画で紹介
ウエスタンブロッティングの操作方法