テクニカルインフォメーション
ELISAの基本操作 ~実験~
ELISAプレートの作製方法と抗原抗体反応に関して解説します。
実験の流れ
1. 抗体(抗原)コート
2. ブロッキング

3. サンプル調製と反応
4. 検出抗体との反応
5. 検出と測定
市販のELISAプレートを準備します。
自作の場合はELISA用プレートに抗体(抗原)をコートします。
室温で約1時間反応します。
|
ELISAキット ELISA kit(研究用)96ウェルプレートフォーマット |
|
攪拌・遠心・振とう装置 WSC-2800 MyMiniVortex マイミニボルテックス |
抗体(抗原)が吸着しなかった部位をブロッキングします。
コート後のプレートに添加し、室温で約1時間反応します。
|
ブロッキング試薬 AE-1475 EzBlock Chemi イージーブロック ケミ (5×Conc.,500mL) |
標準物質の希釈系列を作製し、目的サンプルを適宜希釈して調製します。
ブロッキング後のプレートに添加し、室温で約1時間反応します。
|
サンプル調製・希釈液 WSE-7420 EzRIPA Lysis kit イージーリパライシスキット |
|
振とう装置 |
サンプルを除去して洗浄し、検出用抗体(抗原)を添加します。
室温で約1時間反応します。
|
洗浄液 WSE-7430 EzPBS(-) イージーピービーエス (10×Conc.,1L) |
検出用抗体(抗原)を除去して洗浄し、基質を添加します。
プレートリーダー等で発光/蛍光/発色値を測定します。
|
HRP用検出試薬 WSE-7145 EzELISA TMB イージーエライザ TMB(200mL+停止液) |
|
吸光・発光プレートリーダー |
実験方法
5-1. 試薬の調製
コート用希釈液(約20 mL必要です)
50 mM Carbonate buffer(炭酸バッファー)/pH9.6
0.15 gのNa2CO3と0.29gのNaHCO3を蒸留水に添加して混合し100mLにメスアップします。
ブロッキング溶液(約250 mL必要です)
AE-1475 EzBlock Chemi (5×Conc.)、AE-1476 EzBlock BSA(5×Conc.)、AE-1477 EzBlock CAS(5×Conc.)
原液を蒸留水で5倍希釈します。ELISAプレートの場合、Tween 20を添加する必要はありません。詳細は取扱説明書をご参照ください。
※自作する場合は1%BSA含有PBSなどを使用します。
洗浄液(抗体希釈にも使用可能)
WSE-7430 EzPBS(-) (10×Conc.)、WSE-7230 EzTBS(10×Conc.)、WSE-7235 EzTween (10%)
原液を蒸留水で10倍希釈し、終濃度0.05~0.1%Tween 20(洗浄液には必須)を添加して混合します。詳細は取扱説明書をご参照ください。
※自作する場合は0.1%Tween 20含有PBSなどを使用します。
検出試薬
WSE-7145 EzELISA TMB、WSE-7110 EzWestLumiOne、WSE-7120L EzWestLumi plus
使用方法は各取扱説明書をご参照ください。
※使用する検出用抗体の標識酵素に応じた基質を準備します。基質により検出方法(呈色・発光・蛍光)や測定波長が異なりますので、ご注意ください。
※自作する場合は0.5-1 mg/mL o-phenylenediamine/50mM phosphate-citrate buffer (pH5.0)/0.03% H2O2などの基質と反応停止液(2~3 M H2SO4など)を使用します。
抗体(コート用と検出用)
コート(キャプチャー)用抗体と検出用抗体
検出用抗体が標識されていない場合は、検出用抗体に対する標識抗体で間接的に検出します。
5-2. 抗体コート
- コート(キャプチャー)用抗体をコート用希釈液で2~10 µg/mLに希釈して、約10 mLに調製します。
抗体がウェルの壁面になるべく付着しないように、底面にチップの先を付けるようにして、ゆっくり入れます。96ウェルのELISAプレートの1ウェル当たりに必要な抗体量は100 µLです。固相の表面加工によって違いますが、抗体の吸着量は400~600 ng/ウェルといわれています。 - 工程1の希釈した抗体溶液を96ウェルプレートの1ウェル当たり100 µL添加します。
室温で1時間以上、あるいは4℃でO/Nインキュベートします。抗体により吸着条件が異なります。温度や時間などの条件により、検出感度や測定領域などが変わる場合がありますので、ご注意ください。 - コート用抗体をアスピレーターなどを使用して除去し、洗浄液(PBS-Tなど)を250 µL/ウェル添加します。
洗浄液を除去し、もう一度、洗浄液を250 µL/ウェル添加します。この操作を3回繰り返してプレートを洗浄します。コートした抗体がウェルの壁面や底面以外の部位に付着しないようにするため、アスピレーターやピペットで吸引して除去します。洗浄液はウェルを逆さにして振ることで廃液することもできます。また洗浄液を入れた洗瓶などを使用し、直接各ウェルに十分量注ぎ入れて洗浄することもできます。洗浄液はペーパータオルなどにプレートを叩きつけて、充分に水切りしてください。
|
|
抗体(抗原)のコート チップの先端をウェルの底面に付けるようにして、ゆっくり注入します。泡が入った場合は、針などを使用して除去します。 |
5-3. ブロッキング
- ブロッキング溶液を96ウェルプレートの1ウェル当たり250 µL添加します。室温で約1時間インキュベートします。
反応温度や反応時間などの条件により、検出感度や測定領域などが変わる場合がありますので、ご注意ください。 - ブロッキング溶液を除去し、洗浄液(PBS-Tなど)を250 µL/ウェル添加して、上述と同様の操作で洗浄します。洗浄操作を3~4回繰り返してプレートを洗浄します。
ブロッキング溶液および洗浄液はペーパータオルなどにプレートを叩きつけて、充分に水切りしてください。
コートした抗体(抗原)にも依りますが、ブロッキング液を除き、乾燥させた状態で冷蔵保存可能です。
 |
液切りはしっかりと! 洗浄語などはペーパータオルにプレートをたたきつけて、しっかり液切りします。プレートウォッシャーを使用した場合も同様です。 |
5-4. サンプル調製と反応
- 測定するサンプルを洗浄液などで適宜希釈します。またターゲットとなるタンパク質濃度が分かる標準物質を洗浄液などで希釈し、標準曲線を作製するための希釈系列を作製します。
- 標準物質の希釈系列、およびサンプルを96ウェルプレートの1ウェル当たり100 µL添加します。室温で約1時間インキュベートします。
反応温度や反応時間などの条件により、検出感度や測定領域などが変わる場合がありますので、ご注意ください。 - 標準物質とサンプルをアスピレーターなどを使用して除去し、洗浄液(PBS-Tなど)を250 µL/ウェル添加して、上述と同様の操作で洗浄します。洗浄操作を3~4回繰り返してプレートを洗浄します。
標準物質やサンプルが他のウェルやウェルの壁面などに付着しないようにするため、アスピレーターやピペットで吸引して除去します。洗浄後の洗浄液はペーパータオルなどにプレートを叩きつけて、充分に水切りしてください。
5-5. 検出用抗体との反応
- 検出用の酵素標識抗体を洗浄液などで適宜希釈します。
酵素標識抗体がポリクローナル抗体や高力価の二次抗体(IgG等に対する)などの場合、交差反応が生じることやバックグラウンドが高くなることがあります。ブロッキング溶液、もしくはブロッキング溶液を洗浄液で1/2~1/10希釈した溶液で、酵素標識抗体を希釈すると軽減できる場合があります。 - 検出用の酵素標識抗体を96ウェルプレートの1ウェル当たり100 µL添加します。室温で約1時間インキュベートします。
反応温度や反応時間などの条件により、検出感度や測定領域などが変わる場合がありますので、ご注意ください。 - 検出用の酵素標識抗体をアスピレーターなどを使用して除去し、洗浄液(PBS-Tなど)を250 µL/ウェル添加して、上述と同様の操作で洗浄します。洗浄操作を3~4回繰り返してプレートを洗浄します。
酵素標識抗体が他のウェルやウェルの壁面などに付着しないようにするため、アスピレーターやピペットで吸引して除去します。洗浄後の洗浄液はペーパータオルなどにプレートを叩きつけて、充分に水切りしてください。
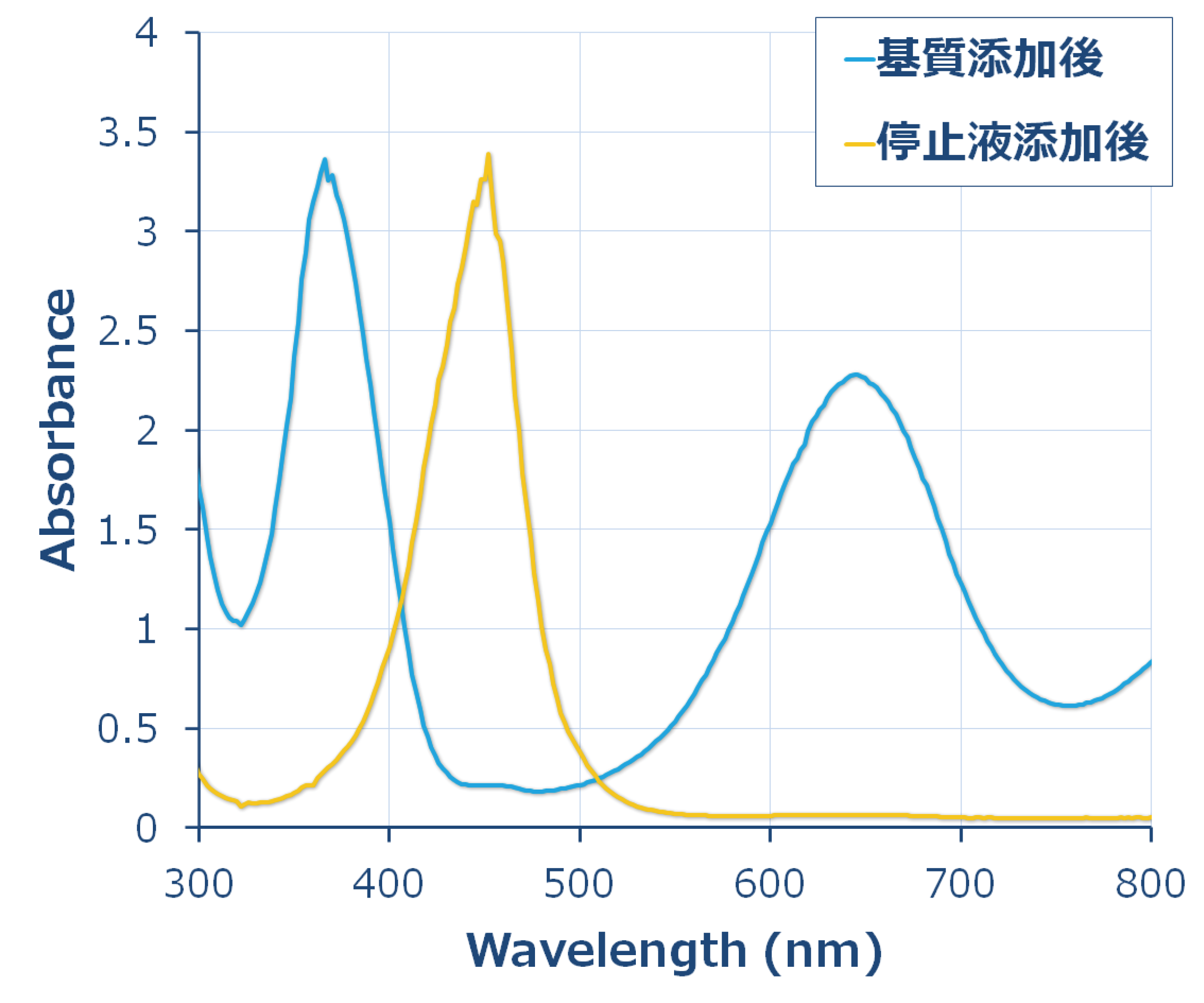 |
TMB基質の波長スペクトルの変化 酵素反応が開始されると、 370nmと652nmに極大波長をもつ青色に変化します。このままでも測定可能ですが、STOP solutionを添加すると反応が停止して、直ちに 450nmに極大波長をもつ黄色に変化します。 |
5-6. 検出と測定
- 検出用抗体の標識酵素に対する基質溶液を96ウェルプレートの1ウェル当たり50~100 µL添加します。
発光基質や蛍光基質を使用する場合は、基質溶液を添加してすぐに測定します。 - 室温(暗所)で約5~30分間インキュベートします。
ご使用になる基質によって反応時間、温度などの反応条件は異なりますので、ご注意ください。 - 反応停止溶液を96ウェルプレートの1ウェル当たり50~100 µL添加します。
ご使用になる基質によって反応時間、温度などの反応条件は異なりますので、ご注意ください。 - プレートリーダー等の計測機器で吸光度(もしくは発光/蛍光)を測定します。
下表は、主な基質の測定波長などが示されています。詳細はご使用になる酵素や基質の添付文書などを参照してください。
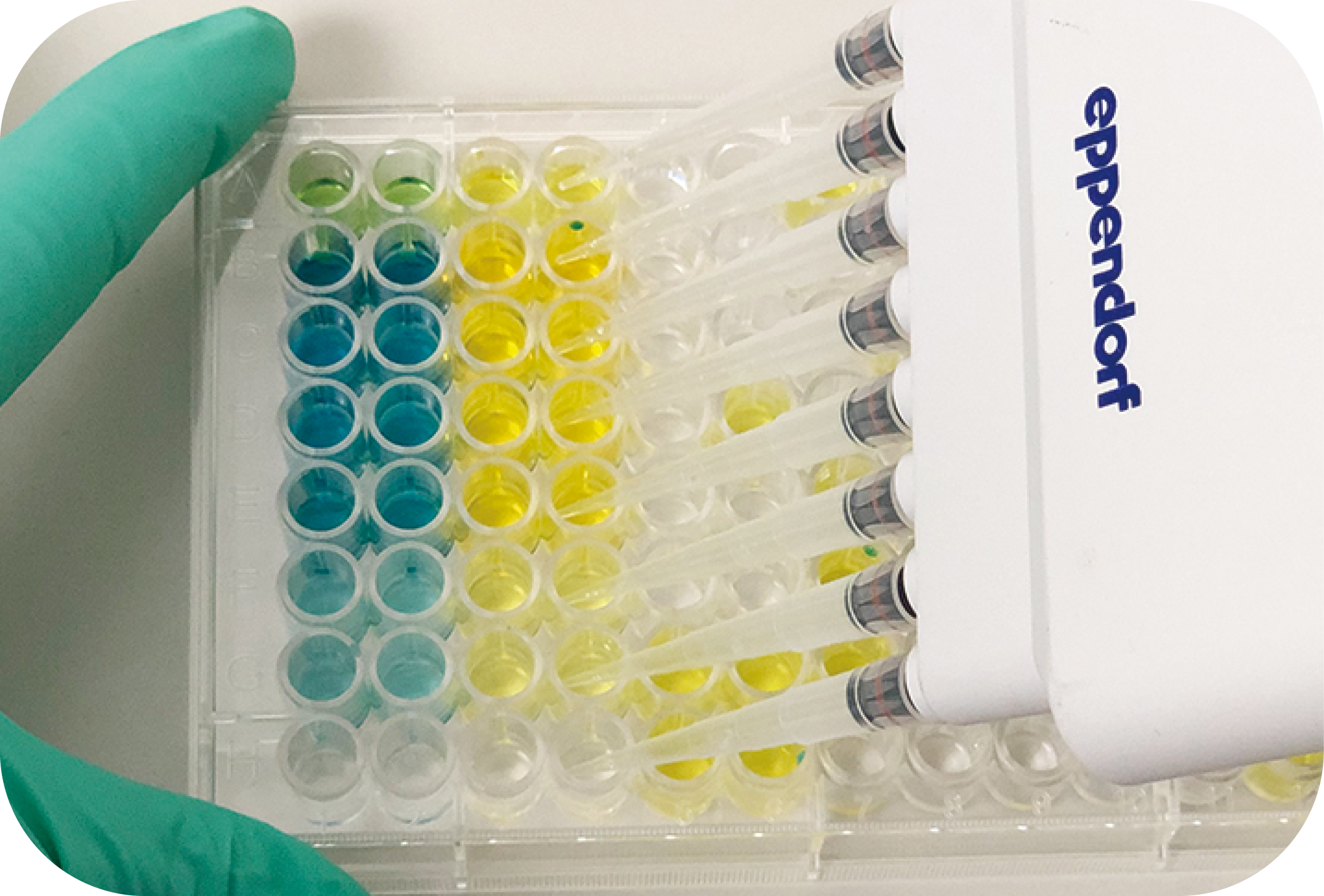 |
TMB基質の発色変化 プレートの左側2列(青~青緑)は反応停止前のTMB基質の発色です。反応停止液を添加すると、直ちに黄色に変化します(3列目から右側)。 |
| 酵素基質 | 検出法 | 波長(反応中) | 波長(反応停止後) | 検出感度 | 検出感度 | |
|---|---|---|---|---|---|---|
|
HRP |
TMB | 発色:吸光度 | 370/652 nm (青) | 450 nm (黄) | ~5 pg/well | 50 pg/mL |
| ABTS | 発色:吸光度 | 650 nm (青) | 410 nm (黄) | ~250 pg/well | 2.5 ng/mL | |
| OPD | 発色:吸光度 | 490 nm (緑) | 450 nm (橙) | ~7 pg/well | 70 pg/mL | |
| Luminol | 発光 | 極大波長:410~425 nm | 500 fg/well | 5 pg/mL | ||
| Amplex Red | 蛍光 | 励起:571 nm/蛍光:585 nm | ~20 pg/well | 2 ng/mL | ||
|
ALP |
PNPP | 発色:吸光度 | 405nm (黄) | 405 nm (黄) | ~10 ng/well | 100 ng/mL |
| CDP-Star | 発光 | 極大波長:440~460 nm | ~5 pg/well | 50 pg/mL | ||
| AttoPhos | 蛍光 | 励起:440 nm/蛍光:560 nm | ~1 pg/well | 10 pg/mL | ||
解析方法
ELISA法の解析方法には定量的解析法、半定量的解析法と定性的解析法があります。
定量的分析(Quantitative)
標準物質を段階希釈して得た測定値を使用して標準曲線を作成します。標準曲線からサンプル中に含まれる標的分子の濃度を換算し、定量的に解析します。標準物質がない場合、もしくは標準曲線の作成が難しい場合など、リファレンスに対して増減を相対的に評価する半定量的解析方法もあります。
定性的分析(Qualitative)
陽性・陰性判定の閾値(カットオフ値)を設定し、サンプル中に標的分子が存在するか「陽性」、しないか「陰性」を定性的に解析します。標的分子の存在の有無は、ネガティブコントロールやポジティブコントロール、あるいはキャリブレーションコントロールとサンプルの測定値を比較し、定性的に判断します。
検量線作成(Calibration curve)
標準物質を階段希釈し(4点以上の濃度)、各濃度を3点以上、測定波長とプレート由来のバックグラウンドを減算するためのリファレンス波長を測定します。ブランクサンプル(溶媒・希釈液等)の値も測定し、各測定値からその値を減算します。一般的にELISA法では4又は5パラメーターロジスティックが使用されますが、測定範囲、標準物質の希釈率、抗体の力価、酵素の検出感度などにより、様々な検量線(標準曲線)が利用されます。データの適合性を評価するために計算される相関係数(R:correlation coefficient)は-1<R<1の範囲の値になり、0のときは相関性がなく、1(又は-1)のときは直線上にデータが並びます。R2値が0.99以上の値を示した場合はとても適合性が高い検量線であると判断できます。
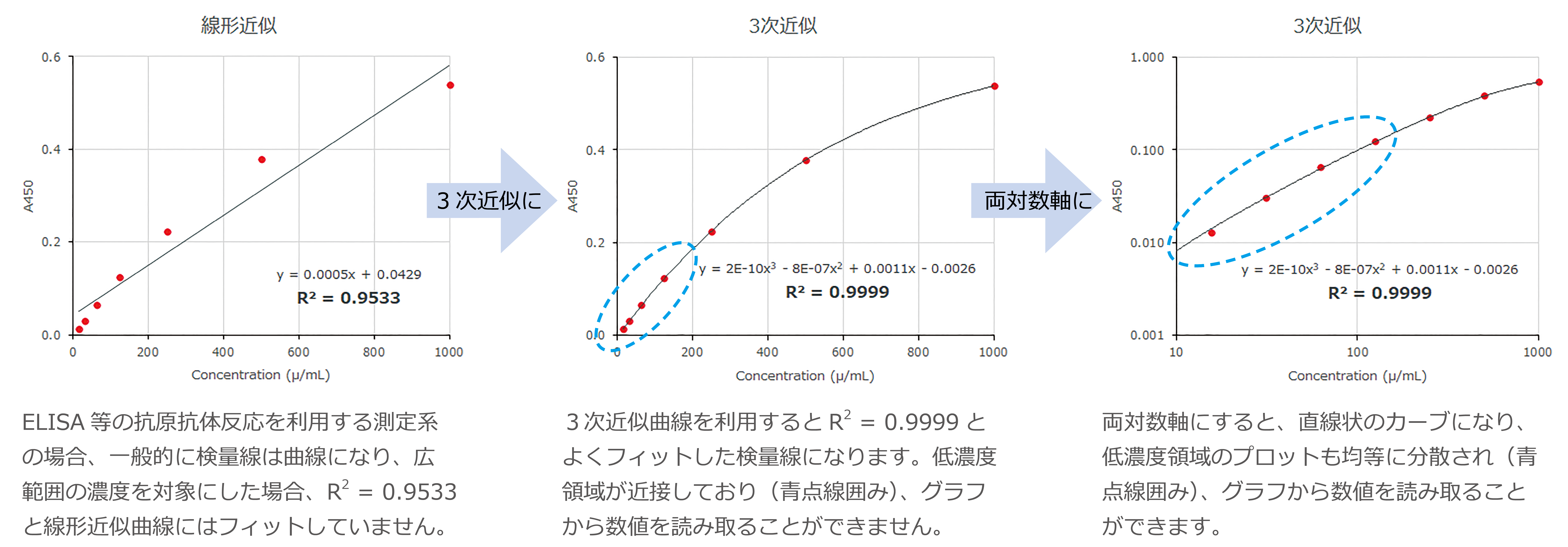
検量線で使用される主な近似曲線
| 近似曲線 | 近似式 |
|---|---|
|
線形近似(1次回帰) |
Y=a*x+b |
|
4次近似(4次回帰) |
Y=a+b*x+c*x2+d*x3 |
|
3次近似(3次回帰) |
Y=a+b*x+c*x2 |
|
対数近似 |
Y=a+b*log(x) |
|
指数近似 |
Y=a*exp(b*x) |
|
4パラメーターロジスティック |
Y=d+(a-d)/(1+(x/c)b) |
測定精度と感度
測定精度は標準物質の品質、サンプルの調製法、抗体の特性、測定法や装置など様々な要因によって影響を受けます。同一のサンプルを、同一のELISAプレートで、複数ウェル測定した時の測定値のバラつきに関して評価します。精度の評価には変動係数(CV: Coefficient of Valiation)が利用されており、一般的に5%以下の値であれば精度が良いといわれています。
CV=標準偏差(SD)/平均値(MEAN)×100(%)
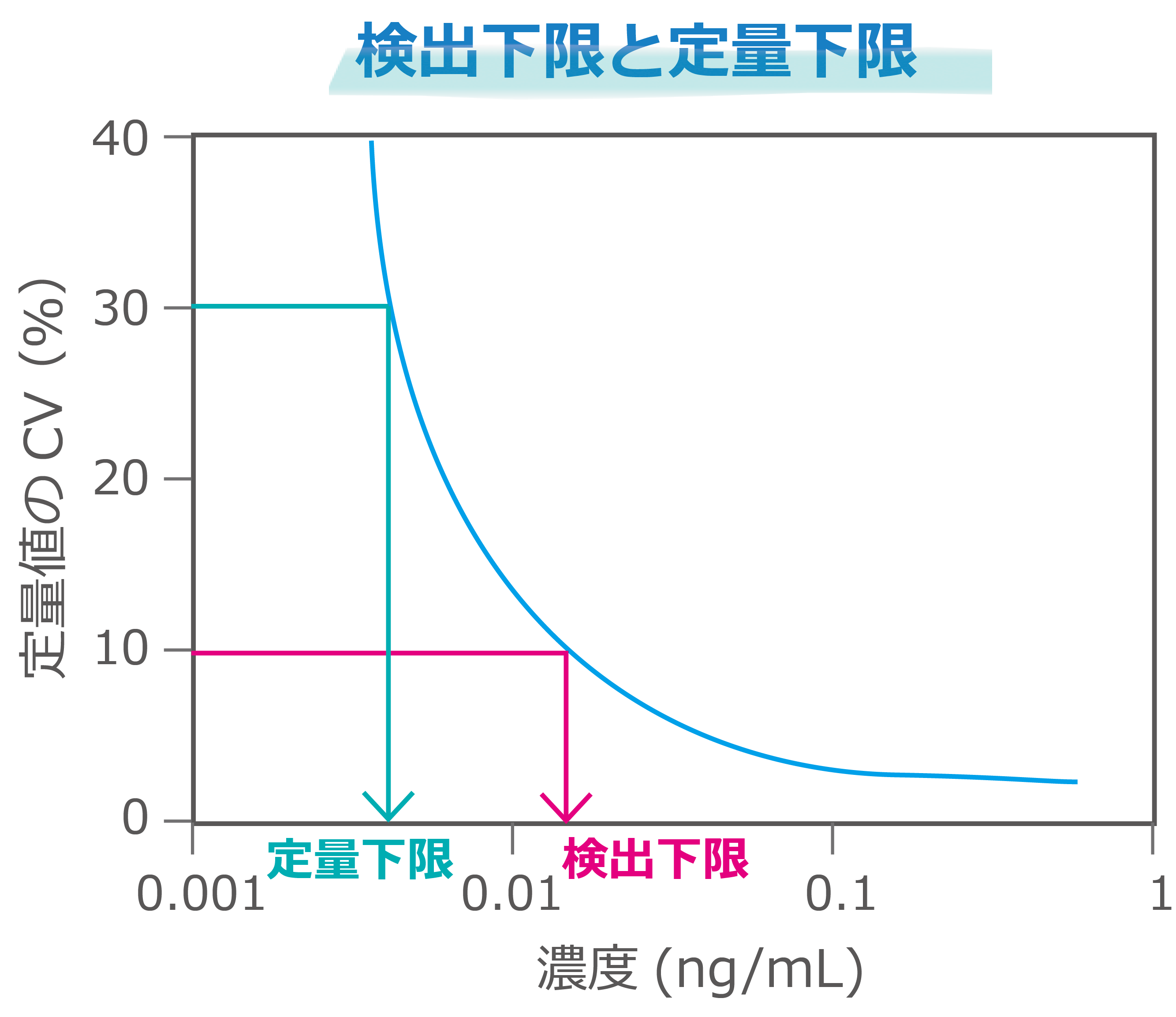
測定感度は検出下限や定量下限として評価されます。検出下限(DL: Detection Limit)はサンプルに含まれるターゲットの検出可能な最小限の量(濃度)のことで、真度や精度がなくても検出できれば良いとされています。JIS規格K0462によると、定量値のCVが30%を示すターゲットの量(濃度)を検出下限とするとされています。
検出下限(DL)=3.3*ブランク測定値のSD/検量線の勾配
一方、定量下限(QL: Quantitation Limit)はサンプルに含まれるターゲットの定量可能な最小限の量(濃度)のことで、適切な精度と震度で定量できる量とされています。JIS規格K0462によると、定量値のCVが10%を示すターゲットの量(濃度)を定量下限とするとされています。
定量下限(QL)=10*ブランク測定値のSD/検量線の勾配
実験データ例
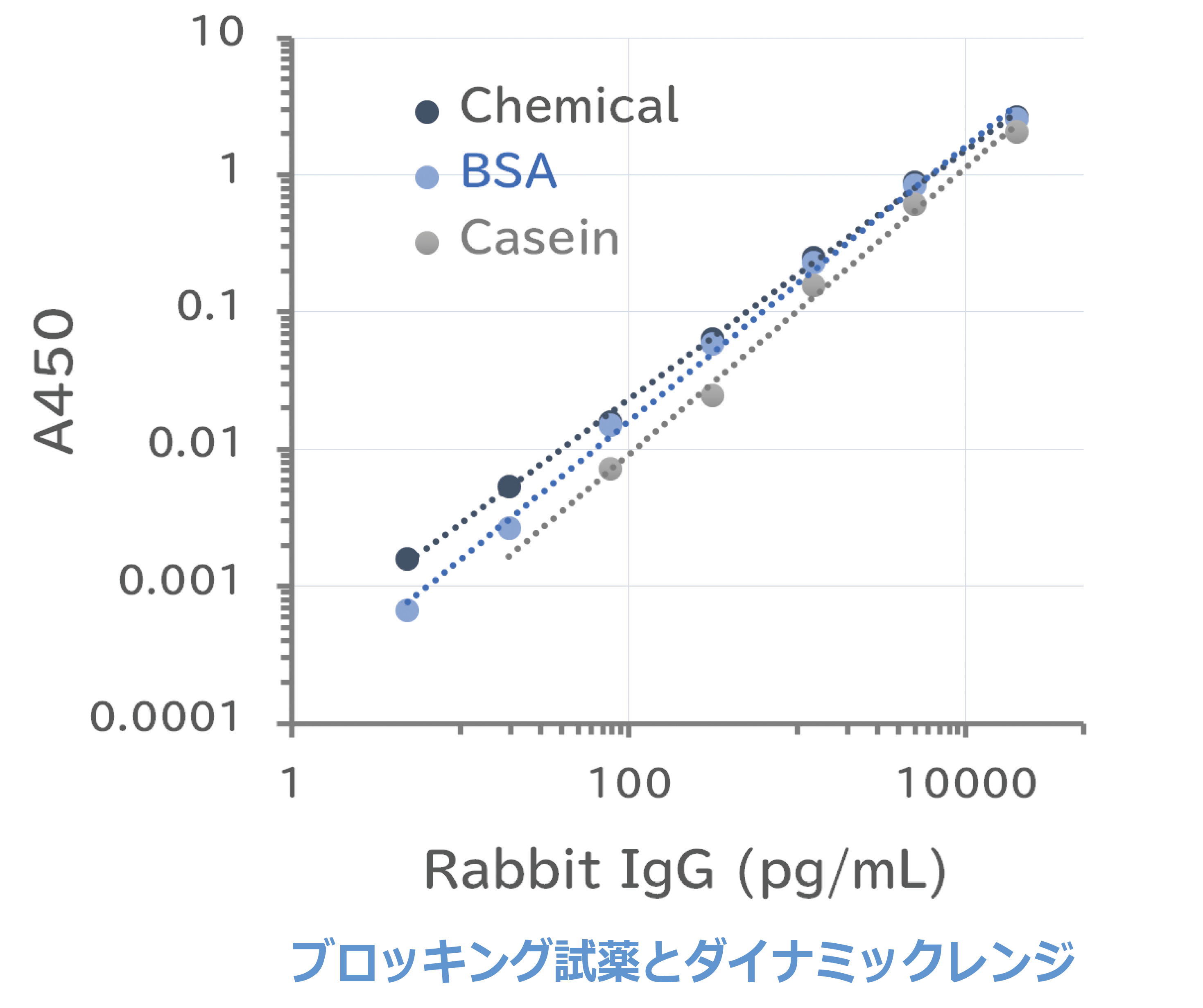
ブロッキング剤による影響
ウサギIgGの20 ng/mLからの1/4希釈系列をELISA用96ウェルプレートにコートし、室温で1時間ブロッキングしました。HRP標識抗ウサギIgG抗体との反応後、HRP用発色基質 により検出し、450nmの吸光度を測定しました。グラフは作成した標準曲線を示しています。いずれのブロッキング試薬を使用しても同様に、広い直線性ダイナミックレンジを示しています。
| コート: ウサギIgG (20 ng/mL~1/4希釈系列) 50µL/ウェル 室温1時間反応 ブロッキング: EzBlock Chemi (ATTO AE-1475) 室温1時間反応 EzBlock BSA (ATTO AE-1476) 室温1時間反応 EzBlock CAS (ATTO AE-1477) 室温1時間反応 検出用抗体: 1/1000希釈HRP標識抗ウサギIgG抗体 室温1時間反応 基質: EzELISA TMB (ATTO WSE-7145) 室温10分反応後停止 測定装置: Phelios AL (ATTO WSL-2300) |
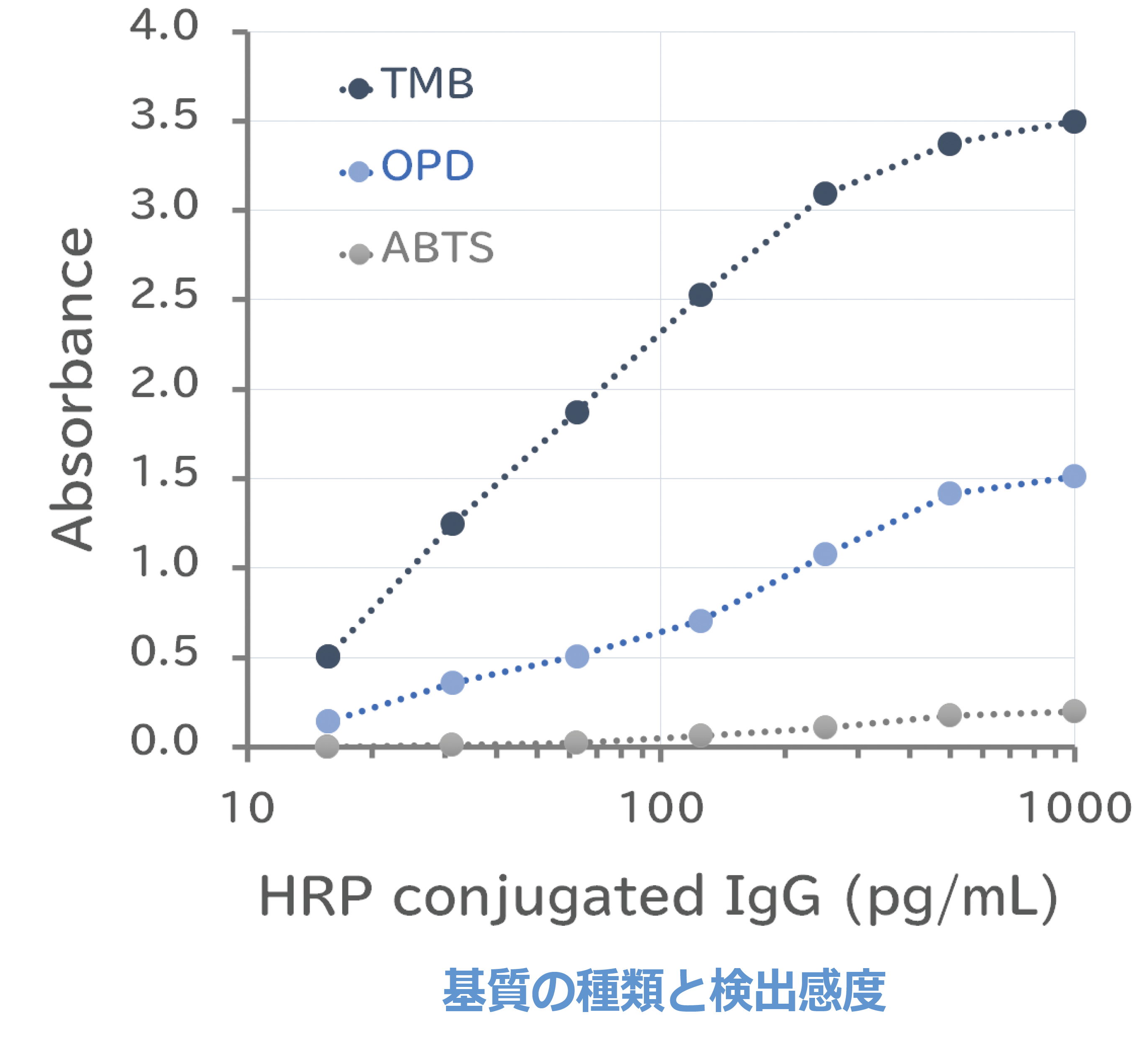
基質による検出感度の違い
HRP標識抗ウサギIgGの1000 pg/mLからの1/2希釈系列を作製し、50 µL/ウェル添加した後、3種類のHRP発色基質で検出しました。右上グラフは30分後に酵素反応を停止して、各基質に適した吸光度(TMB ;450 nm、OPD;490nm、ABTS;410nm)を測定した結果を示しています。
| コート: HRP標識抗ウサギIgG抗体 (1 ng/mL~1/2希釈系列) 100µL/ウェル 室温1時間反応 基質: EzELISA TMB (ATTO WSE-7145)、OPD、ABTS 測定装置: Phelios AL (ATTO WSL-2300) |
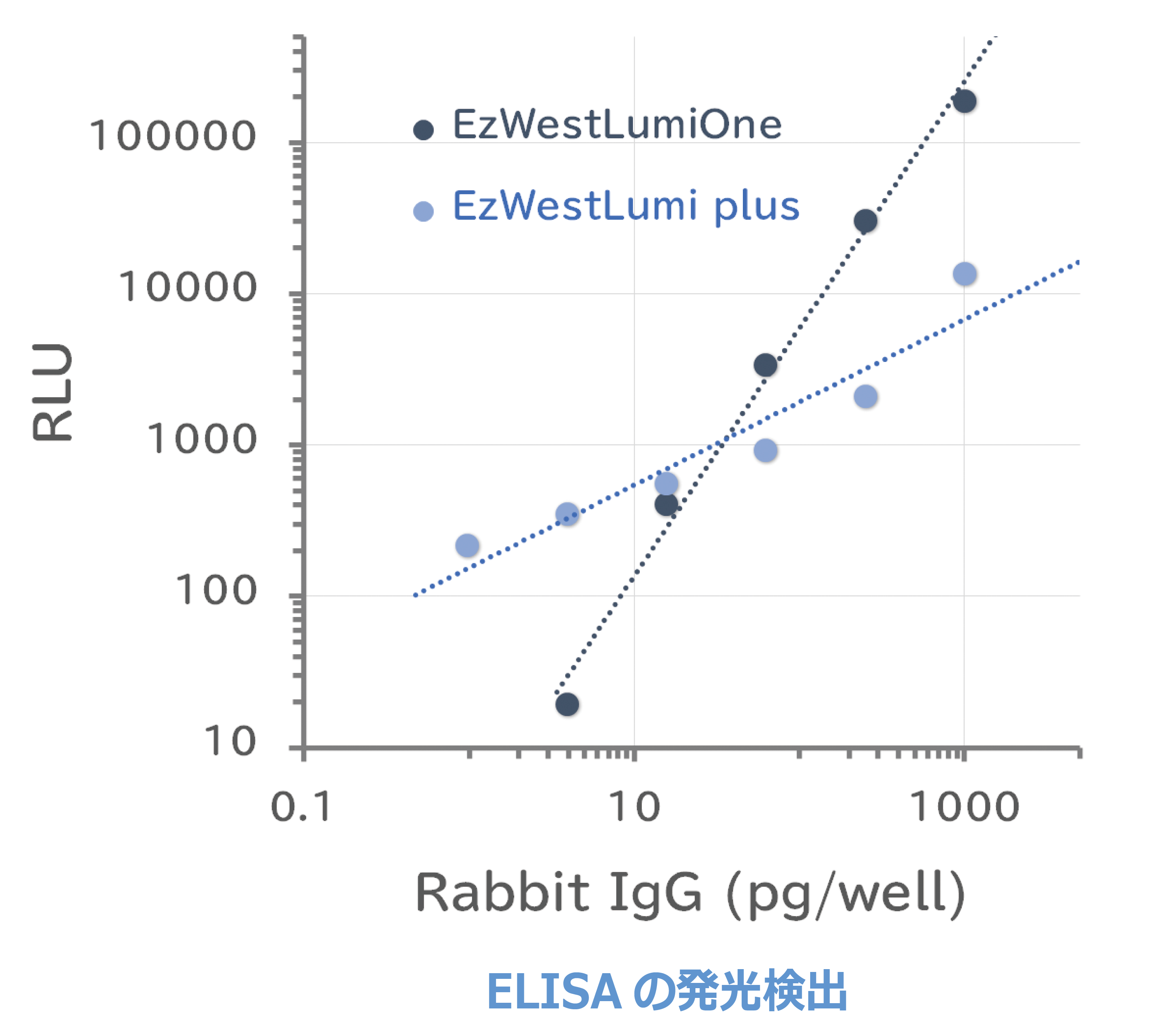
基質による検出感度の違い
ウサギIgGの20 ng/mLからの1/4希釈系列をELISA用96ウェルプレートにコートし、室温で1時間ブロッキングしました。HRP標識抗ウサギIgG抗体との反応後、HRP用発光基質 により検出しました。右下グラフはPhelios ALで発光測定し、解析した結果を示しています。EzWestLumiOneはS/N比、直線性も高く検出できます。加えてEzWestLumi plusはさらに高感度に低濃度の抗原を検出できます。
| コート: ウサギIgG (20 ng/mL~1/4希釈系列) 50µL/ウェル 室温1時間反応 ブロッキング: EzBlock BSA (ATTO AE-1476) 室温1時間反応 検出用抗体: 1/1000希釈HRP標識抗ウサギIgG抗体 室温1時間反応 基質: EzWestLumiOne (ATTO WSE-7110) EzWestLumi plus (ATTO WSE-7120) 測定装置: Phelios AL (ATTO WSL-2300) |
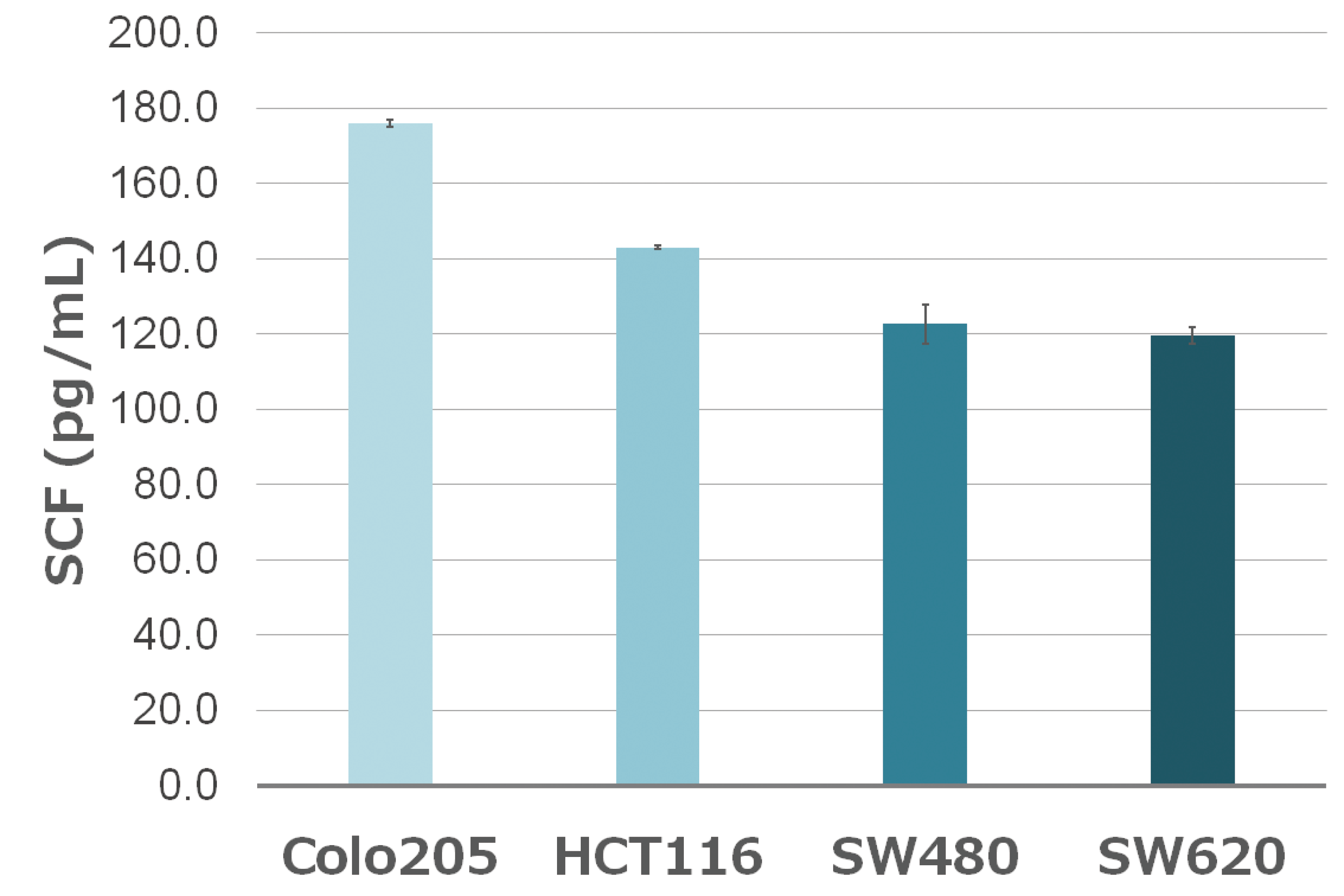
ELISA法による大腸がん細胞株のHuman SCFの測定
大腸がん細胞株中で発現しているSCF (Stem Cell Factor) 量をサンドイッチELISAキットで測定した結果を示しています。 SCFは血液幹細胞や他の組織(細胞)にも発現が見られ、 悪性腫瘍で過剰発現が観察されるとの報告があります。悪性度が高いといわれているColo205やHCT116細胞株の方が、より発現量が高い結果が示されました。
| ELISAプレート:Human SCF Assay Kit (ATTO 6027141) 標準物質: Human SCF(3200 pg/mL~1/2希釈系列) 室温1時間反応 検出用抗体: HRP標識抗Human SCF抗体 室温30分間反応 基質: TMB (キット付属品) 測定装置: Phelios AL (ATTO WSL-2300) |