テクニカルインフォメーション
酵母CLucレポーターアッセイのコツ
1. β-Galに替わるアッセイ法
ウミホタルルシフェラーゼ(CLuc)を用いた酵母レポーターアッセイは、CLucが分泌型発光酵素であることから、従来から酵母で用いられてきたβーガラクトシダーゼ(β-Gal)によるレポーターアッセイと比較して、以下のような特徴を有しています。
また、幾つかのプロモーター活性を比較したところ、その相対値はβ-Galの結果と対応しており(参考文献)、β-Galに替わるアッセイ法として期待できます。
| 特徴 | 理由 |
|---|---|
| 迅速・高感度 | 発光で測定するため |
| 集菌・細胞破砕が不要 | 分泌型酵素であるため |
| 同一サンプルの経時変化が追える | 分泌型酵素で、かつ少量の培地のサンプリングで測定できるため |
2. 培養液・基質溶液の注意点
CLucは酵母で生産されて培養液に分泌されるため、培養液環境の影響を受けます。したがって培養・測定において以下の点に注意が必要です。
(1)培養液のpH
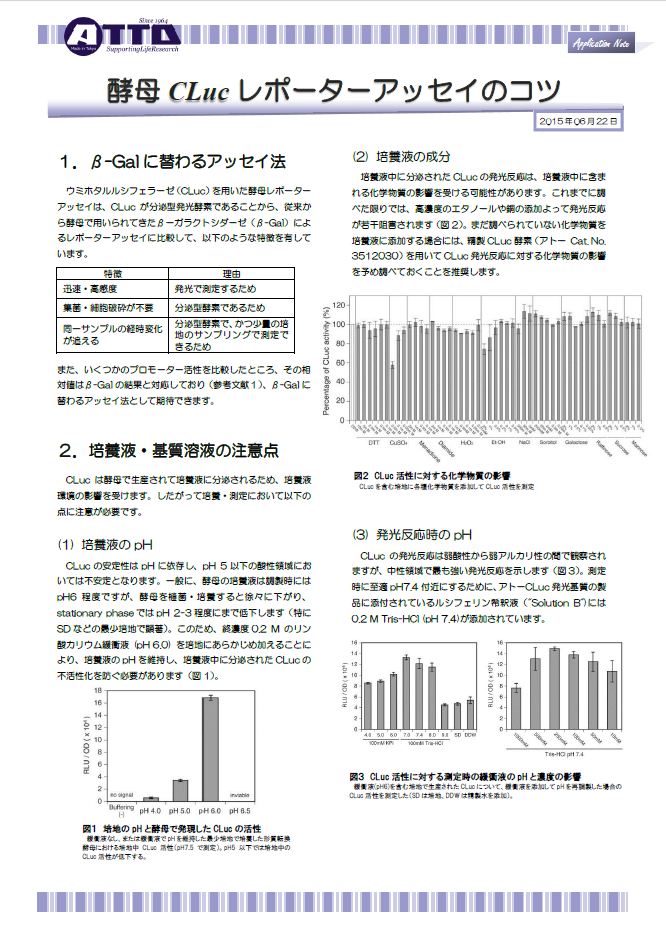
CLucの安定性はpHに依存し、pH 5以下の酸性領域においては不安定となります。
一般に、酵母の培養液は調製時にはpH6程度ですが、酵母を植菌・培養すると徐々に下がり、stationary phaseではpH 2-3程度にまで低下します(特にSDなどの最少培地で顕著)。
このため、終濃度0.2 M のリン酸カリウム緩衝液 (pH 6.0) を培地にあらかじめ加えることにより、培養液のpHを維持し、培養液中に分泌されたCLucの不活性化を防ぐ必要があります(図1)。
(2) 培養液の成分
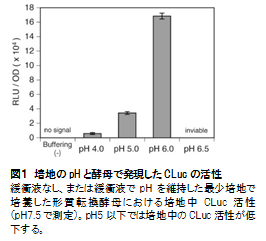
培養液中に分泌されたCLucの発光反応は、培養液中に含まれる化学物質の影響を受ける可能性があります。
これまでに調べた限りでは、高濃度のエタノールや銅の添加よって発光反応が若干阻害されます(図2)。
まだ調べられていない化学物質を培養液に添加する場合には、精製CLuc酵素を用いてCLuc発光反応に対する化学物質の影響を予め調べておくことを推奨します。
(3)発光反応時のpH
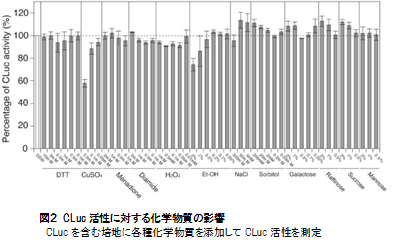
CLucの発光反応は弱酸性から弱アルカリ性の間で観察されますが、中性領域で最も強い発光反応を示します(図3)。
測定時に至適pH7.4付近にするために、アトーCLuc発光基質の製品に添付されているルシフェリン希釈液(Solution B)には0.2 M Tris-HCl (pH 7.4)が添加されています。
3. CLuc活性測定と標準化 (Normalization)
(1)濁度OD600による標準化
β-Galのような細胞内レポーター酵素を用いてプロモーターの転写活性を測定する場合、一般的に細胞溶解液のタンパク質濃度を測定し、レポーター酵素活性を蛋白質濃度で除して標準化します。
一方、分泌タンパク質であるCLucは、細胞数でCLuc活性を標準化できるため、アッセイ系を劇的に簡略化することが可能です。
細胞数を代表する値として濁度OD600(660 nmなどでも可)を測定し、CLuc活性をOD600で除することによって標準化を行います。
[転写活性値] = [CLuc発光値] / OD600
培養液の組成やプロモーターの強度によって条件が変動する可能性がありますが、対数増殖期であればCLuc活性とOD600の値の相関は直線性を示すことが過去の検討において示されています(参考文献 Fig. 2a)。
(2)遠心分離を省略可能
一般的に培養液中の酵素活性を測定する際には、遠心分離により細胞を除去し、その上清を調製する必要があります。
一方、酵母CLucレポーターアッセイでは、形質転換酵母が存在する培養液のままでCLuc活性を検出できます。
形質転換酵母を含む培養液を使った場合のCLuc発光値は、遠心分離で細胞を除去して測定したCLuc発光値よりも若干高い値となりますが、いずれも細胞数(OD600)との相関があるため、
形質転換酵母を含む培養液のままCLuc活性を測定することができます。
形質転換酵母を含む培養液の方が高いCLuc活性を示すのは、分泌途中のCLucも発光反応を触媒するためと考えられます。
(3) 活性の経時変化を測定
CLucは培養液中に分泌されるので、培養液の一部を分取してCLuc酵素活性とマイクロプレートOD600を測定することにより、一つのサンプルで転写活性の経時変化を測定することができます。
この場合、経時的に培養液を採取して測定しますが、全ての時間の採取終了後にまとめて測定する場合に注意することがあります。
酵母が存在する培養液は採取後も酵母がCLucを分泌するため徐々に酵素活性が上昇していきます。
このため、全てのサンプル採取終了後にまとめて測定したい場合などは、採取後すぐに遠心分離により菌体を除去し、上清を適宜測定まで冷蔵または冷凍保存することを推奨します。
4. 定量性確保のための培養方法
(1)定量性のあるOD600の範囲
CLucは前述のとおりpHを制御された培養液中では比較的安定であるため、時間と共に培養液中に蓄積します。
このため培養の後期にはOD600で除する標準化をしても、すでに培養液中に蓄積したCLucのために発光値が高くなる傾向にあります(参考文献Fig. 2a)。
したがって、定量性が認められる範囲(OD600で除する標準化が可能な範囲)で測定するには、96ウェルマイクロプレートに200 µLを入れてプレートリーダーで測定したOD600(以下「マイクロプレートOD600」と記します)が0.1ー0.4であることを確認してCLuc酵素活性を測定することが推奨されます(1 cm角キュベットを用いて吸光度測定した場合にはおよそ0.2-0.8に相当します)。
(2)OD600を調整するための培養
前述のように、定量性が認められる範囲(OD600で除する標準化が可能な範囲)でCLuc活性を測定するには、測定時のマイクロプレートOD600が0.1ー0.4となるように植菌することが重要です。
Constitutiveなプロモーター活性を測定する場合は、まず前培養をstationary phaseまで行い、新しい培地に前培養液を適量加え(このとき予定している時間(一晩など)の培養後にマイクロプレートOD600が0.1ー0.4となるように加減して植菌する)、培養後にCLuc酵素活性とマイクロプレートOD600を測定することが推奨されます。
Inducibleなプロモーターを使って誘導剤の影響を調べる場合は、まず前培養をstationary phaseまで行い、新しい培地に前培養液を適量加え(このとき、予定している時間(一晩など)の培養後にマイクロプレートOD600が(低めの)0.05ー0.2となるように植菌する)、次いで誘導剤を添加し、適当な時間経過後にCLuc酵素活性とマイクロプレートOD600を測定します。
プロモーターの活性に依存しますが、誘導剤添加後2時間以降に活性測定をすることを推奨します。
また、誘導前のCLuc活性が既に高い場合などは、誘導剤添加の際、遠心分離により培養液を除去し、新しい培地と誘導剤を添加してから再度培養するという方法もあります。
5. 実験例
参考文献
Y. Tochigi et al. : Sensitive and Convenient Yeast Reporter Assay for High-Throughput Analysis by Using a Secretory Luciferase from Cypridina noctiluca. Anal. Chem. 82, 5768–5776 (2010)
[PubMed][Full Text]
執筆・監修
産業技術総合研究所 扇谷 悟
日本獣医生命科学大学 栃木裕貴
例1: Constitutiveな転写活性の測定 (試験管培養の場合)
1.CLucレポーターベクターで形質転換した酵母S. cerevisiaeのプレートから中程度の大きさのコロニーを複数個採取し※1、
試験管の液体培地(終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)入り※2)に接種する。
2.至適温度条件下でstationary phaseに達するまで培養を行う(例えば30℃、一晩~二晩)。これを前培養とする※3。
3.前培養液の一部(例えば25 µL)を、新しい試験管の液体培地(例えば5 mL)に接種する※4。
前培養液の量は決めた時間※5培養したあとで、マイクロプレートOD600の値が0.1ー0.4程度となるように調節する。
4.培養後、培養液200 µLを透明な96ウェルマイクロプレートに移し、プレートリーダーでOD600(「マイクロプレートOD600」)を測定する。
発光値を測定するのに適したマイクロプレートOD600値は0.1ー0.4程度。
5.培養液20 µLを96ウェルマイクロプレート(黒プレートを推奨)に移し、希釈済みのルシフェリン溶液80 µL※6を加えて、CLuc活性をルミノメーター(AB-2350 Pheliosなど)で測定する。
※1コロニーごとに発現の状況が若干異なります。中程度の大きさのコロニーを複数個混ぜて植菌すると、より安定なデータが得られます。
※2CLucが安定になるpHを維持するため、終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)を培地に加えてください。
リン酸カリウム緩衝液は、培養液とは別にオートクレーブしてから混合することをお勧めします(一部のアミノ酸はpH 6.0では析出することがあります)。
※3定量性を重視する場合、測定時のマイクロプレートOD600を0.1-0.4にすることが重要です。
コロニーを液体培地に植えて前培養無しで、予定した時間にマイクロプレートOD600をこの範囲にコントロールすることは難しいので、前培養して植え替えることをお勧めします。
※4植菌量は、形質転換酵母の増殖速度に依存して調節します。
※5一晩が便利です。
※6希釈にはCLuc発光基質製品に添付の基質希釈液(Solution B)を使用します。
例2:Inducibleな転写活性の測定 (試験管培養の場合)
1.CLucレポーターベクターで形質転換した酵母S. cerevisiaeのプレートから中程度の大きさのコロニーを複数個採取し※1、
試験管の液体培地(終濃度0.2 Mリン酸カリウム緩衝液(pH6.9)入り※2)に接種する。
2.至適温度条件下でstationary phaseに達するまで培養を行う(例えば30℃、一晩~二晩)。これを前培養とする※3。
3.前培養液の一部(例えば25 µL)を、新しい試験管の液体培地(例えば5 mL)に接種する※4。
前培養液の量は、決めた時間※5培養したあとで、マイクロプレートOD600の値が0.05-0.2程度となるように調節する※6。
4.培養後、培養液200 µLを透明な96ウェルマイクロプレートに移し、プレートリーダーでOD600(「マイクロプレートOD600」)を測定する。望ましいマイクロプレートOD600値は0.05-0.2程度※7。
5.培養液に誘導剤を添加し、培養を続ける。誘導が検出できるまで通常2時間程度かかる。
6.適当な時間に、培養液20 µLを96ウェルマイクロプレート(黒プレートを推奨)に移し、
希釈済みのルシフェリン溶液80 µL※8を加えて、CLuc活性をルミノメーター(AB-2350 Pheliosなど)で測定する。
また、同時に培養液200 µLを取り、マイクロプレートOD600を測定する。
発光値を測定するのに適したマイクロプレートOD600値は0.1-0.4程度。
サンプリングを繰り返して転写活性の経時変化を追うこともできる※9。
※1コロニーごとに発現の状況が若干異なります。中程度の大きさのコロニーを複数個混ぜて植菌すると、より安定なデータが得られます。
※2CLucが安定になるpHを維持するため、終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)を培地に加えてください。
リン酸カリウム緩衝液は、培養液とは別にオートクレーブしてから混合することをお勧めします(一部のアミノ酸はpH 6.0では析出することがあります)。
※3定量性を重視する場合、測定時のマイクロプレートOD600を0.1-0.4にすることが重要です。
コロニーを液体培地に植えて前培養無しで、予定した時間にマイクロプレートOD600をこの範囲にコントロールすることは難しいので、前培養して植え替えることをお勧めします。
※4植菌量は、形質転換酵母の増殖速度に依存して調節します。
※5一晩が便利です。
※6誘導剤を添加して、転写活性が検出できるようになるまでしばらく培養が必要となりますが、その間にも酵母は増殖するので、マイクロプレートOD600が低めになるように調節します。
※7直線性を重視する場合、長時間培養することによりマイクロプレートOD600値は0.4を超えないように、誘導剤添加時の培養液のマイクロプレートOD600値は0.1より低くします。
※8希釈にはCLuc発光基質製品に添付の基質希釈液(Solution B)を使用します。
※9全ての時間のサンプル採取終了後にまとめて測定したい場合は、採取後すぐに遠心分離により菌体を除去し、測定まで上清を冷蔵または冷凍保存することを推奨します。
例3:Constitutiveな転写活性の測定 (96ウェルプレートの場合)
1.96ディープウェルプレートの各ウェルに液体培地(終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)入り※1)1 mLを入れ、
CLucレポーターベクターで形質転換した酵母S. cerevisiaeのプレートから中程度の大きさのコロニーを接種する。
2. シールでふたをして※2、至適温度条件下でstationary phaseに達するまで培養を行う(例えば30℃、二晩)。これを前培養とする※3。
3.新しい96ディープウェルプレートの各ウェルに液体培地(終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)入り※1)1 mLを入れ、
前培養液の一部(例えば5 µL)を96ディープウェルプレートの各ウェルに接種する※4。
前培養液の量は、決めた時間※5培養したあとで、マイクロプレートOD600の値が、0.1-0.4程度となるように調節する※6。
4.培養後、培養液200 µlを透明な96ウェルプレートに移し、プレートリーダーでOD600(「マイクロプレートOD600」)を測定する。望ましい値は0.1ー0.4程度。
5.培養液20 µlを96ウェルマイクロプレート(黒プレートを推奨)に移し、希釈済みのルシフェリン溶液80 µL※7を加えて、CLuc活性をルミノメーター(AB-2350 Pheliosなど)で測定する。
※1CLucが安定になるpHを維持するため、終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)を培地に加えてください。
リン酸カリウム緩衝液は、培養液とは別にオートクレーブしてから混合することをお勧めします(一部のアミノ酸はpH 6.0では析出することがあります)。
※2通気性がよく水分を透過しにくいものを使用します(Thermo Scientific社Gas Permeable Adhesive Seal AB-0718など)。
※3定量性を重視する場合、測定時のマイクロプレートOD600を0.1-0.4にすることが重要です。
コロニーを液体培地に植えて前培養無しで、予定した時間にマイクロプレートOD600をこの範囲にコントロールすることは難しいので、前培養して植え替えることをお勧めします。
※4植菌量は、形質転換酵母の増殖速度に依存して調節します。
※5一晩が便利です。
※6ウェルごとに形質転換体が異なる場合は、決めた時間(一晩が便利)培養後に多くのウェルの培養液のマイクロプレートOD600値が0.1〜0.4となるよう、
前培養液の添加量をウェルごとに調節することをお勧めします。
※7希釈にはCLuc発光基質製品に添付の基質希釈液(Solution B)を使用します。
例4:Inducibleな転写活性の測定 (同一の形質転換体を用いた誘導剤の比較など、96ウェルプレートの場合)
1.CLucレポーターベクターで形質転換した酵母S. cerevisiaeのプレートから中程度の大きさのコロニーを複数個採取し※1、
試験管の液体培地(終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)入り※2)に接種する。
2.至適温度条件下でstationary phaseに達するまで培養を行う(例えば30℃、二晩)。これを前培養とする※3。
3.前培養液の一部(例えば500 µL)を、新しいフラスコの液体培地(例えば100 mL)に接種する※4。
前培養液の量は、決めた時間※5培養したあとで、マイクロプレートOD600の値が、0.05ー0.2程度となるように調節する※6。
4.培養後、培養液200 µLを透明な96ウェルプレートに移し、プレートリーダーでOD600(「マイクロプレートOD600」)を測定する。望ましい値は0.05ー0.2程度※7。
5. 96ディープウェルプレートの各ウェルに上記培養液 1 mLを入れ、誘導剤を添加する。発光が検出できるまで2時間程度かかる。
6.適当な時間に、培養液20 µLを96ウェルマイクロプレート(黒プレートを推奨)に移し、希釈済みのルシフェリン溶液80 µL※8を加えて、
CLuc活性をルミノメーター(AB-2350 Pheliosなど)で測定する。
また、同時に培養液200 µlを取り、マイクロプレートOD600を測定する。
発光値を測定するのに適したマイクロプレートOD600値は0.1ー0.4程度。
サンプリングを繰り返して転写活性の経時変化を追うこともできる※9。
※1コロニーごとに発現の状況が若干異なります。中程度の大きさのコロニーを複数個混ぜて植菌すると、より安定なデータが得られます。
※2CLucが安定になるpHを維持するため、終濃度0.2 Mリン酸カリウム緩衝液(pH6.0)を培地に加えてください。
リン酸カリウム緩衝液は、培養液とは別にオートクレーブしてから混合することをお勧めします(一部のアミノ酸はpH 6.0では析出することがあります)。
※3定量性を重視する場合、測定時のマイクロプレートOD600を0.1-0.4にすることが重要です。
コロニーを液体培地に植えて前培養無しで、予定した時間にマイクロプレートOD600をこの範囲にコントロールすることは難しいので、前培養して植え替えることをお勧めします。
※4植菌量は、形質転換酵母の増殖速度に依存して調節します。
※5一晩が便利です。
※6誘導剤を添加して、転写活性が検出できるようになるまでしばらく培養が必要となりますが、その間にも酵母は増殖するので、マイクロプレートOD600が低めになるように調節します。
※7直線性を重視する場合、長時間培養することによりマイクロプレートOD600値は0.4を超えないように、誘導剤添加時の培養液のマイクロプレートOD600値は0.1より低くします。
※8希釈にはCLuc発光基質製品に添付の基質希釈液(Solution B)を使用します。
※9全ての時間のサンプル採取終了後にまとめて測定したい場合は、採取後すぐに遠心分離により菌体を除去し、測定まで上清を冷蔵または冷凍保存することを推奨します。
資料ダウンロード
製品紹介

Clucレポーターアッセイキットは、ウミホタル由来の分泌型ルシフェラーゼの遺伝子・ベクターと発光基質を含む、レポーターアッセイキットです。
細胞外に分泌されるという特長を持ち、細胞毒性も低いことから、長期間の培養に対応できる他、細胞や組織外に分泌されたルシフェラーゼを回収しつつ経時的な変化を調べるexo vivoの測定系を作ることが出来ます。