テクニカルインフォメーション
活性酸素および抗酸化能測定
はじめに
わたしたちは⼤気中の酸素を体内に取り込み、その電⼦の受け渡しによって得られたエネルギーを利⽤して⽣命を維持するシステムをもっています。このシステムは好気的代謝と呼ばれ、酸素を利⽤して糖類、アミノ酸、脂質などを分解してエネルギーを蓄えることができます。またエネルギーの⽣産だけではなく、ホルモンをはじめとする⽣体内の活性物質を合成したり、薬物の解毒などにも関わっています。
⽣体に取り込まれた酸素は、酸化還元反応によって⽔に代わるまでの過程でいくつかの中間体を⽣成します。この中間体は酸素よりも活性が強く、「活性酸素」と呼ばれています。⼀般的には、体内に⼊った酸素の数%が活性酸素に変化すると考えられています。この活性酸素は、⽼化やガンをはじめとする⽣活習慣病を発症させる因⼦であることが知られています。その反⾯、⽣体の防御機構や調節反応をつかさどる重要な因⼦でもあります。
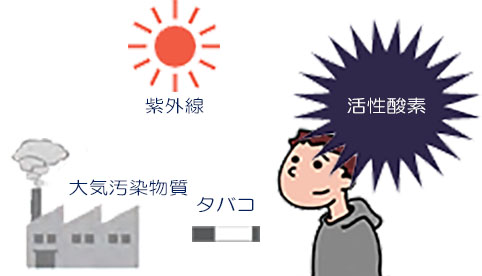
たとえば、お天気の良い⽇に布団や⾐類を⽇光に当てた経験はありませんか︖実はこれは紫外線により⽣成した活性酸素が、布団の中の菌などを殺菌してくれているのです。菌を攻撃するのと同様に、活性酸素はわたしたちの体にも影響を与えます。紫外線による活性酸素は、シワやシミ、⽪膚ガンの原因にもなると考えられています。紫外線の他にも、わたしたちの⾝の回りには活性酸素の発⽣源がたくさんあります。その例を右図に⽰しました。
このように、活性酸素は⽣物にとって薬と毒になる 2 ⾯性を持っており、活性酸素の⽣成と消去のバランスが重要であることがわかります。このバランスが崩れた状態を「酸化ストレス」と呼び、⽣体内の酸化ストレスを評価することは、病気の予防や病態の把握、⽼化の制御などにも役⽴つと期待されています。
活性酸素および抗酸化能測定
活性酸素のお話の前に、まずはフリーラジカルについてご説明します。原⼦は、陽⼦と中性⼦からなる核と、その周囲の軌道にある電⼦から成り⽴っています。電⼦は、通常原⼦や分⼦の周りを 1 つの軌道に対して2つずつ対になって存在していますが、1 つの軌道に対して1つしか電⼦が存在しないことがあります。この1つしかない電⼦のことを不対電⼦といい、不対電⼦をもつ原⼦や分⼦をフリーラジカルと呼びます。フリーラジカルは電⼦が⾜りず安定していないため、安定している原⼦や分⼦から電⼦を1つ奪って安定になろうとします。逆に電⼦を奪われた原⼦や分⼦はフリーラジカルになるので、他の安定したものから電⼦を奪って安定になろうとして、連鎖反応を起こしていきます。
酸素の4電子還元反応
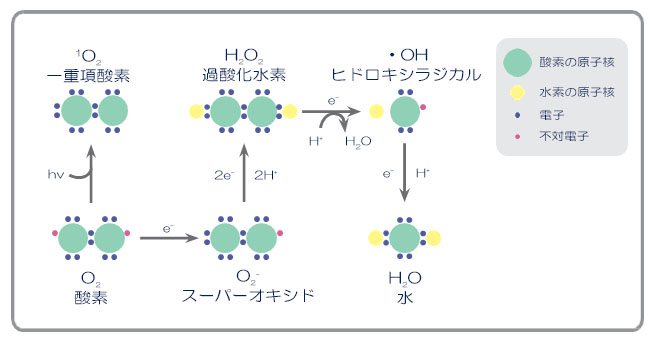
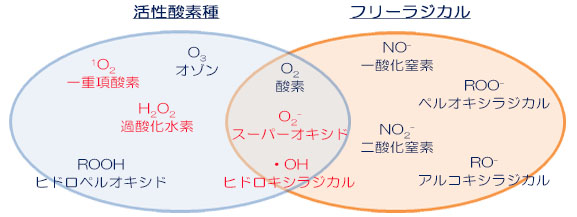
活性酸素の中には、以下の図に示すように、フリーラジカルとフリーラジカルでないものがあります。スーパーオキシド (O2- )、過酸化⽔素(H2O2)、ヒドロキシラジカル (HO・)、⼀重項酸素 ( 1O2) の 4 種類を狭義の活性酸素と呼びます。さらにこの 4 種類の他にも、⽣体での反応で⽣じるペルオキシラジカル、アルコキシラジカル、ヒドロペルオキシド(過酸化脂質)や、⼀酸化窒素・⼆酸化窒素なども広い意味でとらえると、活性酸素の仲間です。
活性酸素種とフリーラジカル
抗酸化とは
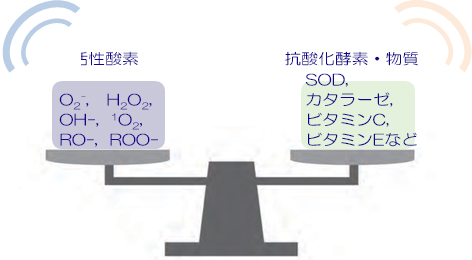
活性酸素の⽣成やその働きを抑制したり、活性酸素そのものを消去することを抗酸化といいます。それぞれの活性酸素には、活性酸素を消去する酵素や物質が存在します。抗酸化酵素であるスーパーオキシドジスムターゼ(SOD)は、O2– をH O とO に不均化します。またカタラーゼは、H O をH OとO にして無毒化します。このほかに⾷事から摂取する⾷品の中にも活性酸素を消去する物質があります。これらは抗酸化物質とよばれ、ビタミン C(アスコルビン酸)や ビタミン E(トコフェノール)、フラボノイド(カテキン)などがあります。これらによって⽣体内の過剰な活性酸素が消去され、バランスが保たれているのです。

ビタミンCとDによる活性酸素消去のしくみ
ちょこっと豆知識
抗酸化酵素や抗酸化物質で防御しきれなかった活性酸素が細胞膜に触れると、膜の脂質から電⼦を奪い連鎖反応を開始します。この連鎖反応によって、細胞膜は障害を起こします。⼀⽅脂溶性の抗酸化剤であるビタミン E は、膜内に存在し、脂質のひとつに電⼦をあげて⾃分はフリーラジカルになります。このビタミン E のフリーラジカルは反応が遅いため、活性酸素の連鎖反応が⽌まり、膜の障害を抑制することができます。また細胞膜外に存在するビタミン C は、電⼦をビタミン E のフリーラジカルに与え、ビタミン E として復活させることができます。このように細胞膜の内外にビタミン Eとビタミン C が豊富に存在すれば、抗酸化作⽤を何倍にも⾼めることができます。
活性酸素と対応する抗酸化酵素/抗酸化物質
「抗酸化酵素」は、特定の活性酸素種のみを消去する活性を有しています。それに対して、「抗酸化物質」は、いくつかの活性酸素種に対して消去する活性を有しています。例えば、スーパーオキシドディスムターゼ(SOD)は、スーパーオキシド(O2-)に対して消去活性を有していますが、過酸化水素やそのほかの活性酸素に対しては消去活性はありません。一方、ビタミンCは、O2–だけでなくヒドロキシラジカル(・OH)に対する抗酸化能も有しています。
| 活性酸素 | 抗酸化酵素 | 抗酸化物質 |
|---|---|---|
|
スーパーオキシド(O2-) |
スーパーオキシドディスムターゼ(SOD) |
グルタチオン |
|
過酸化水素(H2O2) |
カタラーゼ |
|
|
アルコキシラジカル(RO-) ペルオキシラジカル(ROO-) |
|
グルタチオン |
|
ヒドロキシラジカル |
|
グルタチオン |
|
一重項酸素(1O2) |
|
β - カロテン |
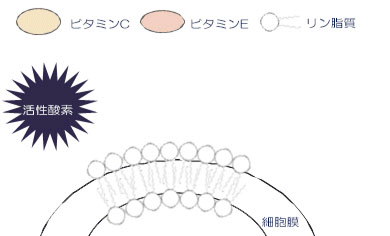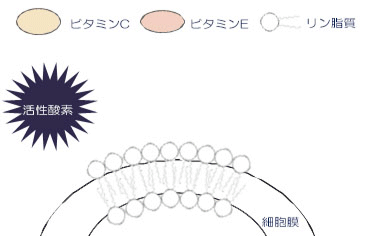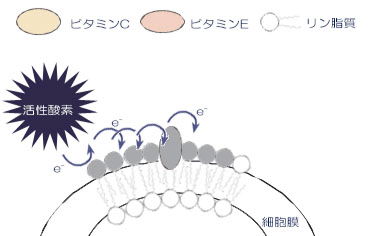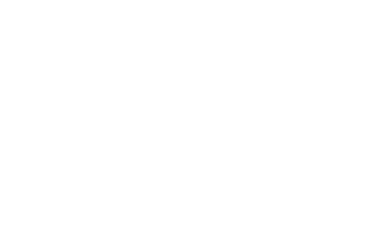
1.活性酸素は、細胞膜の脂質を酸化します。
2.酸化された脂質は、ほかの脂質を連鎖的に酸化します。
3.脂質膜中のビタミンEは、酸化された脂質より電子を受け取り、酸化されます。
4.酸化されたビタミンEは、反応が遅いため、脂質酸化の連鎖反応が遅延されます。
5.酸化されたビタミンEは、ビタミンCにより還元されます。
活性酸素および抗酸化能測定
活性酸素は、反応性が⾼く寿命が短いため直接検出することは困難です。そこで活性酸素を種々のプローブと反応させ、より⻑寿命で検出しやすい化学種に変換する間接法が⼀般的に⽤いられています。活性酸素の測定法には、シトクロム c 還元法や電⼦スピン共鳴法 (ESR 法 )、化学発光法などがあります。シトクロム c 還元法は分光学的⼿法としてはもっとも⼀般的な⼿法です。SOD の酵素単位の決定にも使⽤されていますが、シトクロム c を還元する物質が混在する場合の検出には適しません。また ESR 法は特異性の⾼い⽅法ですが、測定に⼤きな装置が必要となることから簡便性に⽋けます。化学発光法はルミノメータ―で計測ができるため、利便性の⾼い測定⽅法です。アトーではシングルチューブタイプやマルチプレートに対応したルミノメータの取扱いをしており、化学発光法を⽤いての抗酸化能測定を推奨しています。
化学発光法について
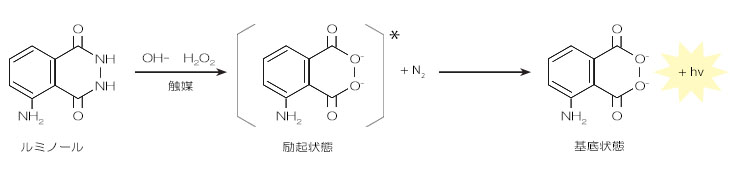
化学反応により物質が励起状態となり、その状態から基底状態に戻るときに発光する現象のことを化学発光といいます。ここでの化学反応はほとんどの場合が酸化反応で、物質が酸化することで励起状態になり発光します。この反応に⽤いられる物質(発光基質)にはルミノールやルシゲニン、ウミホタルルシフェリン (MCLA) などが挙げられます。とくにルミノールは、テレビドラマなどでの犯罪捜査のシーンで⾒かけたことがある⽅も多いのではないでしょうか。ルミノール反応は、アルカリ性⽔溶液中で、酸素、オゾン、過酸化⽔素、次亜塩素酸などの酸化剤と、重⾦属イオン、ペルオキシダーゼ、ヘムタンパク質などの触媒と酸化反応をする際に発光します。以下にルミノールの反応機構を⽰しました。
化学発光試薬を用いたスーパーオキシドの測定
化学発光法を⽤いて活性酸素の検出を⾏う場合、⽬的の活性酸素種との反応性が⾼い発光試薬を選択して使⽤します。アトーでは、O2–と特異的に反応し、430nm に極⼤発光をもつ MPEC を取扱っています。MPEC は中性溶液中で O2と反応性が⾼く、右図に⽰したように従来の発光試薬よりも⾼い S/N が得られます。また溶存酸素との反応性も低いので、低濃度のスーパーオキシドも検出することができます。
抗酸化能測定の原理
CLETA-S はキサンチン / キサンチンオキシダーゼの反応により⽣成した O2–に対する抗酸化能を評価する試薬キットです。発光試薬、基質溶液、酵素溶液、酵素希釈液がセットになっており、簡単に抗酸化能を測定することできます。抗酸化能測定を⾏う場合は、活性酸素発⽣系に対して抗酸化物質を添加し、抗酸化物質の有無による発光強度の違いを評価します。
活性酸素消去能(抗酸化能)の評価方法
抗酸化能の評価は、⼀定量の活性酸素を⽣成させ、対象となるサンプルがどれくらい活性酸素を消去できるかを⽐率として求めます。評価するためには以下のa〜d の測定が必要になります。
a. ネガティブコントロール : 活性酸素非生成下の測定値
b.ポジティブコントロール : 活性酸素生成下の測定値
c.サンプル(N) : 活性酸素非生成下の試料の測定値
d.サンプル(P) : 活性酸素生成下の試料の測定値
上記a~dを以下の式に用いて抗酸化能を比率として算出します。
抗酸化能(%) = 1-[(d-c)/(b-a)] x 100
いくつかの試料の抗酸化能を比較する場合は、それぞれの試料に対して、上記cおよびdの測定し、式にあてはめることで、それぞれの抗酸化能を算出・比較します。
* aは、検出試薬のブランク値になります。
cは、試料のブランク値になります。
| 活性酸素 / 抗酸化能測定⽅法 | 活性酸素 |
|---|---|
|
シトクロム c 還元法 |
スーパーオキシド(O2-) |
|
NBT 還元法 |
O2- |
|
ESR 法 |
O2- / ・OH など |
|
化学発光法 |
O2-/ ・OH / 1O2/ ROOH |
|
DPPH ラジカル法 |
DPPH |
ルミノールの反応機構
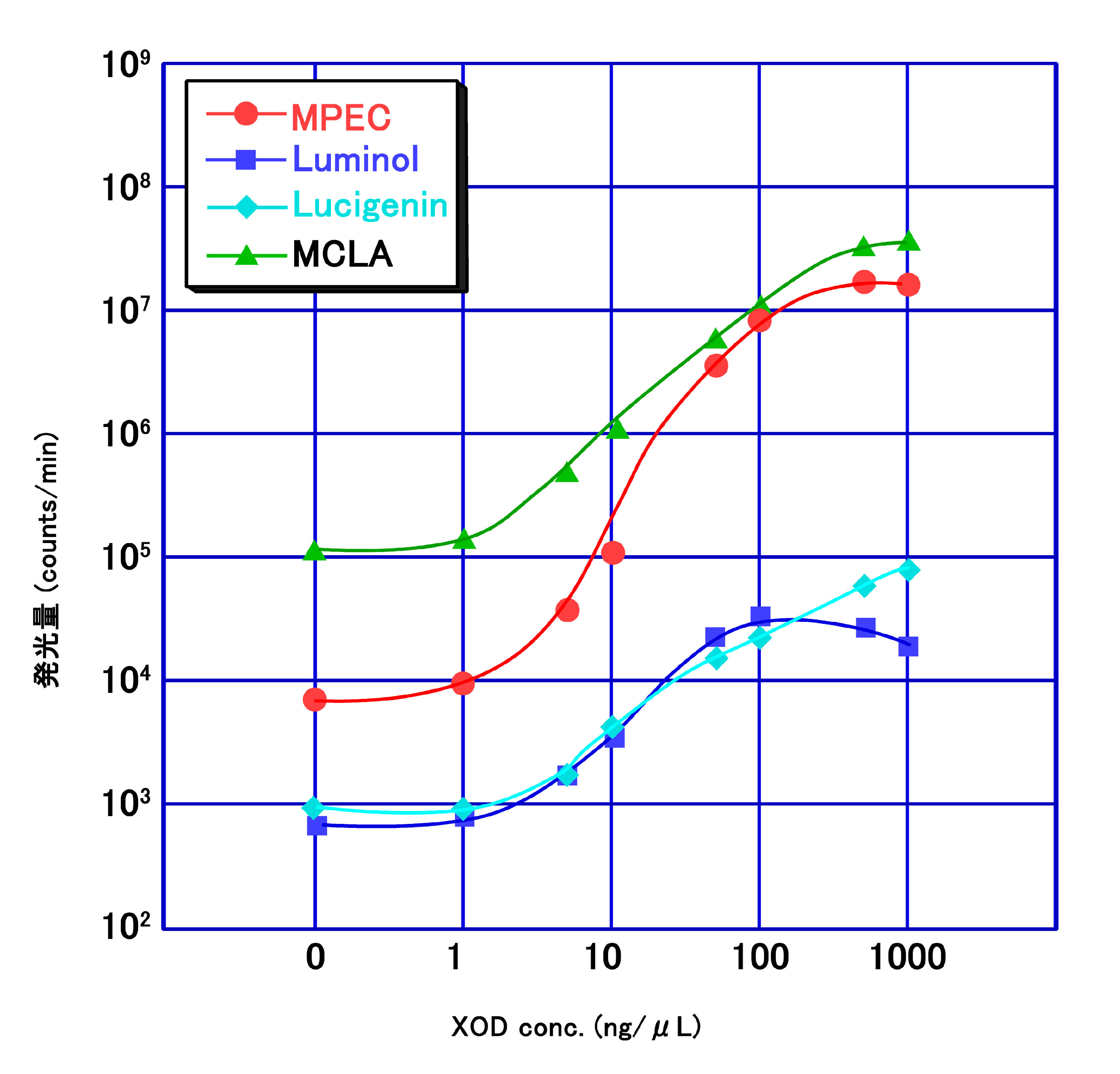
pH7.5のリン酸緩衝液中でキサンチンオキシダーゼとヒポキサンチンから生じたO2-量を4種類の発光試薬を使って測定した結果です。キサンチンオキシダーゼの濃度に依存してしてO2-の発生量が増えるのが確認できます。MCLA(緑)が最も効率良く、O2-と反応して発光しますが、バックグランドの発光が多いことがわかります。また、中性域ではルシゲニンとルミノールの反応効率が悪いこともわかります。
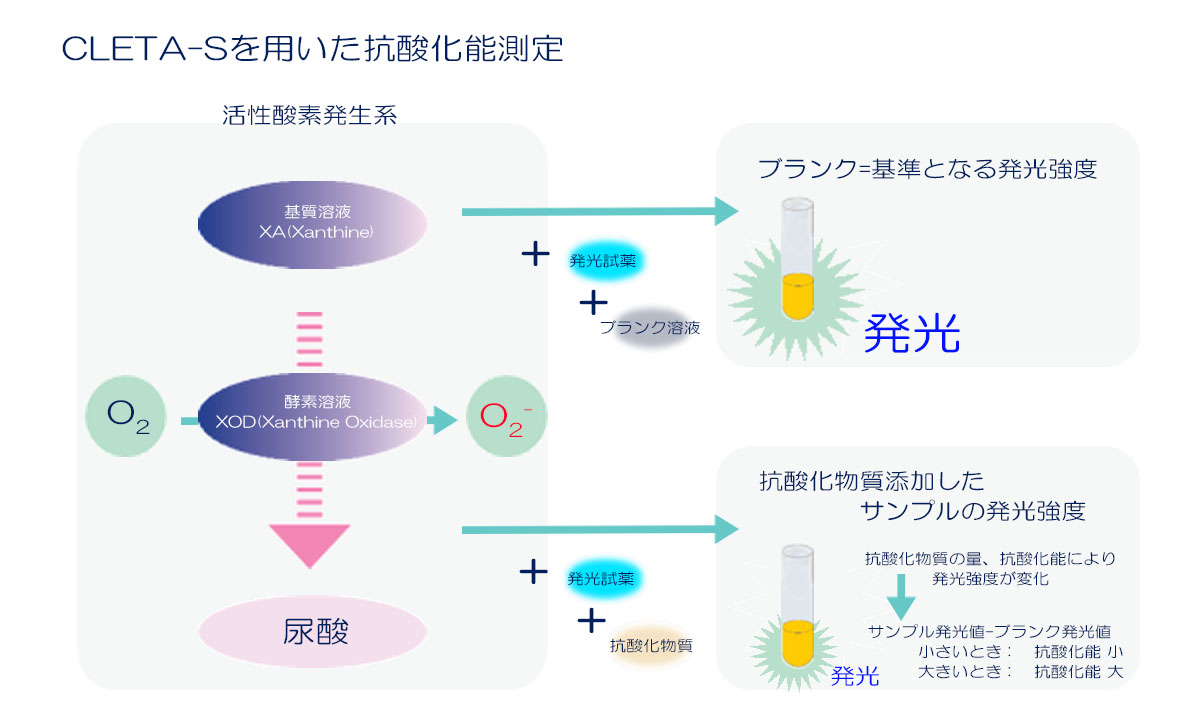
CLETA-S を⽤いてスーパーオキシド消去能を評価するには、上図で⽰したように、基質溶液と酵素溶液を反応させてスーパーオキシドを⽣成させます。その中に発光試薬を添加してルミノメーターで計測することで、スーパーオキシドと発光試薬の反応による発光強度を測定します。これは抗酸化能を評価する上で基準(ブランク)になる発光強度です。前述した系に評価したい抗酸化物質を添加して、同様に発光強度を計測します。ここで得られた2つの計測値を⽐較することで、消去能を評価することができます。
50% 発光阻害濃度 (IC50) について
抗酸化能が 50% となる濃度の 50% 阻害率 (IC50) を⽤いて、複数の試料間の抗酸化能を⽐較する場合があります。IC50 は、評価するサンプルの希釈系列を調製し、サンプル濃度ごとの抗酸化能を算出して求めます。下図に⽰したように、サンプル濃度とサンプル濃度に対する抗酸化能をプロットして、発光阻害率曲線を作成します。発光を 50% 阻害する濃度で、各サンプルの抗酸化能を⽐較します。
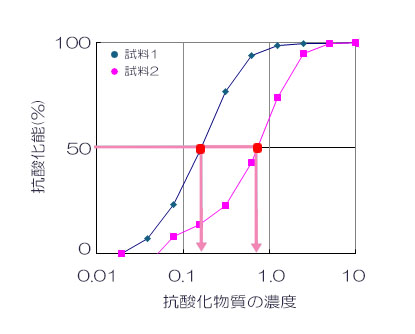
試料1のほうが、試料2よりも、IC50の濃度が低い→抗酸化能が高い
ちょこっと豆知識
実験の流れ
抗酸化能を測定したい試料を適した抽出法で調製します。
スーパーオキシド用発光試薬
AB-2950 MPEC(スーパーオキシド反応系発光試薬)
AB-2970 CLETA-S (スーパーオキシド反応系抗酸化能測定試薬キット)
攪拌・遠心機
WSC-2700 MyMiniSpin(小型遠心機)
WSC-2800 MyMiniVortex(卓上小型ボルテックスミキサー)
下記の4つの発光値を測定します。
a. ネガティブコントロール : 活性酸素非生成下の測定値
b.ポジティブコントロール : 活性酸素生成下の測定値
c.サンプル(N) : 活性酸素非生成下の試料の測定値
d.サンプル(P) : 活性酸素生成下の試料の測定値
ルミノメーター
AB-2350 フェリオス (マイクロプレート型ルミノメーター)
WSL-2300 Phelios AL(吸光・発光測定および微量測定が可能なマルチタイププレートリーダー)
測定した発光値を用いて、以下の式から、比率として発光阻害率を算出します。
抗酸化能(%) = 1-[(d-c)/(b-a)] x 100
サンプル調製
試料は、熱水抽出やエタノール抽出など、試料に適した抽出方法で処理します。
測定に影響する要因としては、以下があります。
試料成分の吸収波長 : 本キットの発光試薬の発行奈長は430nmです。試料に発光試薬の発光波長を吸収する成分が含まれている場合、測定ができない場合があります。
活性酸素生成系の阻害: 試料に、XODの活性を阻害する成分が含まれている場合、O2-発生量が抑えられることから、抗酸化能が低く見積もられる場合があります。
pHによる影響:pHが低い場合、XODの酵素反応、発光試薬の反応は、低くなります。また、発生したO2-の寿命も短くなります。
ポジティブ/ネガティブコントロールを含め、すべての溶液で、試料調製で用いた溶媒などで、試料と同程度のpHとなるようにしてください。
発光測定
測定は、1測定あたり、以下の試薬を混合して測定します。
a.試料 または ブランク溶液 10uL
b.発光試薬 10uL
c.酵素溶液 または 酵素希釈液 80uL
d.基質溶液 200uL
*発光試薬は、あらかじめ使用する量だけ、融解します。
*bとcは、測定時にまとめて混合・調製します。
(1) 酵素希釈・発光試薬混合溶液の調製
1 測定につき発光試薬 10 μ L と酵素希釈液 80 μ L を使⽤します。
混合溶液は測定する試料数の 4 回分+ 2 回分程度をまとめて作製します。混合時は転倒混和してください。
(2) 酵素・発光試薬混合溶液の調製
1 測定につき発光試薬 10 μ L と酵素溶液 80 μ L を使⽤します。
混合溶液は測定する試料数の 4 回分+ 2 回分程度をまとめて作製します。混合時は転倒混和してください。
(3) ネガティブコントロールの測定
測定容器にブランク(試料を調製した)溶液 10μL と(1)の溶液 90μL を分注します。
測定容器を装置にセットして基質溶液を 200 μ L 分注します。10 秒間発光測定します。
(4) ポジティブコントロールの測定
測定容器にブランク(試料を調製した)溶液 10μL と(2)の溶液 90μL を分注します。
測定容器を装置にセットして基質溶液を 200 μ L 分注します。10 秒間発光測定します。
(5) サンプル(N)の測定
測定容器に試料 10μL と(1)の溶液90μL を分注します。
測定容器を装置にセットして基質溶液を 200 μ L 分注します。10 秒間発光測定します。
(6) サンプル(P)の測定
測定容器に試料 10μL と(2)の溶液 90μL を分注します。
測定容器を装置にセットして基質溶液を 200 μ L 分注します。10 秒間発光測定します
96well plateでのサンプルレイアウト例

発光阻害率の算出
測定した発光値を用いて、以下の式で比率として、発光阻害率を算出します。
抗酸化能(%) = 1-[(d-c)/(b-a)] x 100
a. ネガティブコントロール : 活性酸素非生成下の測定値
b.ポジティブコントロール : 活性酸素生成下の測定値
c.サンプル(N) : 活性酸素非生成下の試料の測定値
d.サンプル(P) : 活性酸素生成下の試料の測定値
実施例1
SOD の消去活性測定
使⽤機器、材料およびストック溶液
・CLETA-S
・SOD
・0.1M リン酸カリウム溶液 (pH7.5)
・蒸留⽔
・AB-2350 フェリオス
・96well ブラックプレート
・マルチチャンネルピペット など
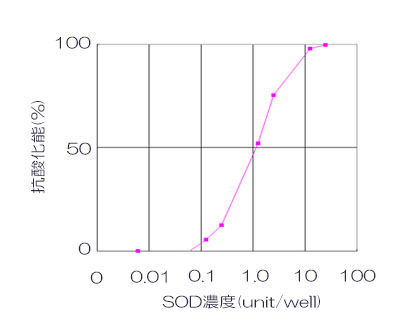
サンプル調製
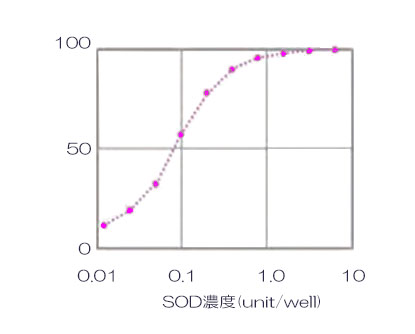
SOD は 50units/well 〜 1/2 希釈系列になるように 0.1M リン酸カリウム溶液 (pH7.5) で調製しました。
測定
96well ブラックプレートに 1 計測あたり以下の溶液を混合して、フェリオスで10 秒間発光測定しました。
試料またはブランク溶液 10uL
発光試薬 10uL
酵素溶液または酵素希釈液 80uL
基質溶液 200uL
結果
発光値から SOD 濃度による発光阻害率の検量線を作成しました。検量線は、縦軸に発光阻害率(%)、横軸に対数⽬盛で SOD 濃度をとり作成しました。検量線より、 SOD の 50% 阻害率(IC50)は、0.26units/well であることが確認できました。
実施例2
柑橘類果汁の抗酸化能測定
使⽤機器、材料およびストック溶液
・CLETA-S
・柑橘類(京都府産 温州みかん、千葉県産 夏みかん、茨城県産 すだち、千葉県産 ゆず、南アフリカ産 ピンクグレープフルーツ)
・0.1M リン酸カリウム溶液 (pH7.5)
・蒸留⽔
・AB-2350 フェリオス
・96well ブラックプレート
・マルチチャンネルピペット など
| 可⾷部 100g あたりのビタミンC 含量 (mg) | 抗酸化能 (%) | |
|---|---|---|
|
温州みかん |
33 |
1.20 |
|
夏みかん |
38 |
1.26 |
|
すだち |
40 |
1.35 |
|
ゆず |
40 |
1.20 |
|
ピンクグレープフルーツ |
36 |
1.00 |
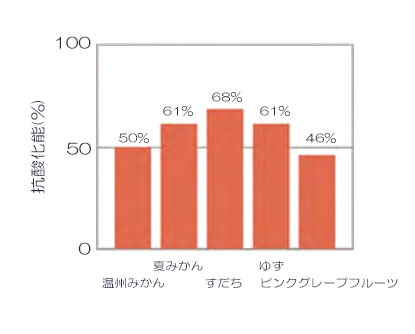
サンプル調製
柑橘類は果汁を⼿で搾汁して遠⼼し、上清を 0.1M リン酸カリウム溶液 (pH7.5)で 5 倍希釈したものを試料としました。
測定
96well ブラックプレートに 1 計測あたり以下の溶液を混合して、フェリオスで10 秒間発光測定しました。
試料またはブランク溶液 10uL
発光試薬 10uL
酵素溶液または酵素希釈液 80uL
基質溶液 200uL
結果
発光値より抗酸化能を算出した結果を左図に⽰しました。また⽇本⾷品標準成分表 2020 年版(⼋訂)より、可⾷部 100g あたりのビタミン C 含量とビタミン C含量に対する抗酸化能を左表に⽰しました。スーパーオキシド消去能はすだちが最も⾼いことが確認できました。成分表を参照すると、すだちに含まれるビタミン C は他の柑橘類よりも多く、抗酸化能とビタミン C の相関性が確認できました。
実施例3
煎茶の抽出方法による抗酸化能の違い
使⽤機器、材料およびストック溶液
・CLETA-S
・煎茶
・0.1M リン酸カリウム溶液 (pH7.5)
・蒸留⽔
・AB-2350 フェリオス
・96well ブラックプレート
・マルチチャンネルピペット など
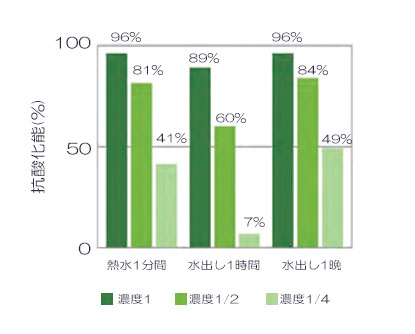
サンプル調製
煎茶 1g に対して 43mL の蒸留⽔で右表の⽅法で抽出し、遠⼼後の上清を 0.1M リン酸カリウム溶液 (pH7.5) で 1:1としたものを濃度 1 とし、0.1M リン酸カリウム溶液 (pH7.5)で 2 倍希釈系列を調製しました。
| 抽出⽅法 | |
|---|---|
|
熱⽔抽出 |
1 分間 |
|
⽔出し |
冷蔵庫にて 1 時間 |
|
⽔出し |
冷蔵庫にて 1 晩 |
測定
96well ブラックプレートに 1 計測あたり以下の溶液を混合して、フェリオスで10 秒間発光測定しました。
試料またはブランク溶液 10uL
発光試薬 10uL
酵素溶液または酵素希釈液 80uL
基質溶液 200uL
結果
測定した発光値より、抗酸化能を算出した結果を左図に⽰しました。煎茶の濃度依存的に抗酸化能が変化することが確認できます。
熱⽔で 1 分間抽出したものと⽔出しで 1 時間抽出したものでは、熱⽔抽出した⽅が抗酸化能が⾼いことが確認できました。煎茶に含まれる苦渋味成分であるエピガロカテキンガレートは、80℃以上で抽出されるため、熱⽔抽出の⽅が抗酸化能が⾼くなったと考えられます。また⽔出しで 1 時間おいたものと⼀晩おいたものでは、⼀晩おいた煎茶の⽅が抗酸化能が⾼いことがわかります。カテキン濃度は冷⽔で 1 時間以上抽出してもほとんど変わらないことが知られているため、カテキン以外の成分が溶出して抗酸化能が⾼くなったと推測できます。
実施例4
HL60 細胞が生成する活性酸素の測定
使⽤機器、材料およびストック溶液
・培養細胞︓HL60,HL60 (1.25% DMSO で分化誘導 )
・1mM MCLA
・10kU/mL SOD
・10% FBS/ROMI1640
・1mg/mL PMA
・蒸留⽔
・AB-2270 ルミネッセンサー Octa
・φ 12 × 55mm テストチューブ
・マイクロピペット など
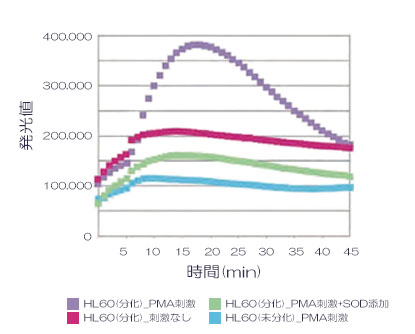
サンプル調製
① HL60 は、適当な培地でコンフルエントになるまで培養します。
② 細胞を 10% FBS/ROMI1640 で洗浄し、1 × 106sells/mL になるよう 10% FBS/ROMI1640 で懸濁します。
測定
① 細胞懸濁液をテストチューブに 1mL 採取します。
② ①に 1mM MCLA を1μL 添加してボルテックスミキサーで混合します。
③ ②をルミネッセンサー Octa にセットして 5 分間発光測定します。
④ 計測中のテストチューブに PMA(1 μ L) あるいは DMSO(1 μ L)、SOD(10 μ L) を添加し、ボルテックスミキサーで混合します。
⑤ ルミネッセンサー Octa で発光測定します。
結果
発光値の経時変化を左図に⽰しました。未分化の HL60 は、スーパーオキシドの⽣成が確認できませんでしたが、分化した HL60 は、PMA 刺激によりスーパーオキシドの⽣成が確認できました。そこへ抗酸化物質である SOD を添加することにより、スーパーオキシドが消去されることが確認できました。
Phelios ALを用いた抗酸化能の測定
フェリオス AL を⽤いて抗酸化能を測定しました。まず活性酸素が安定して⽣成する酵素濃度を確認しました。CLETA-S の酵素溶液を酵素希釈液で希釈し、基質溶液を添加後に装置にセットして測定した発光値と、同じマイクロプレートを 10 分後に測定した発光値を下表に⽰しました。
基質溶液を添加すると反応がすぐに始まり、スーパーオキシドが⽣成します。表に⽰した測定値より、酵素溶液原液では、基質溶液の添加から測定までの間に発光反応が減衰して発光値が 5 倍希釈溶液よりも⼩さい値になりました。また原液と 5 倍希釈溶液では、10 分後には基質が消費されて発光値が下がることが確認できました。⼀⽅で、 15 倍、20 倍希釈溶液では添加直後の発光値と 10 分後の発光値にほとんど差がなく、スーパーオキシドが安定して測定できることが確認できました。

| 酵素溶液濃度 | 発光値 | ||
|---|---|---|---|
| 添加直後 | 添加 10 分後 | ||
|
原液 |
729,120 |
102,098 |
|
|
5 倍希釈 |
1,196,598 |
756,690 |
|
|
15 倍希釈 |
36,834 |
36,461 |
|
|
20 倍希釈 |
16,552 |
16,232 |
|
左記の結果を踏まえて、15 倍希釈した酵素溶液を⽤いて SOD の消去活性測定を⾏い、発光阻害率を求めた結果を図に⽰しました。
このように分注機能がない場合でも、抗酸化能の測定を⾏うことができます。ただし基質溶液を添加してから測定までの間に発光値が減衰しないような条件の検討が必要です。
ちょこっと豆知識