テクニカルインフォメーション
SDSポリアクリルアミドゲル電気泳動(SDS-PAGE) 基本操作
電気泳動はタンパク質固有の電荷や分子量の違いを利用して、電気で各分子を分離する手法です。最もよく使用されるSDS-PAGE (SDS Polyacrylamide gel electrophoresis)は、タンパク質にSDSを付加して負に帯電させ、アクリルアミドゲルのメッシュ構造を利用して、タンパク質の分子量の違いでふるい分けます。今回はアトーの製品を使用したSDS-PAGE用の基本操作に関してご紹介します。
実験の流れ
1.サンプル調製
細胞や組織などからRIPAやSDSサンプルバッファーでタンパク質を抽出し、SDS処理および還元処理を行います。
使用する製品
タンパク質抽出・サンプル調製液
(EzSubcell series, EzApply)
ブロックインキュベータ
(MyMini Block)
3.電気泳動

SDSポリアクリルアミドゲル電気泳動によりタンパク質を分離します。目的タンパク質により、アクリルアミドの濃度を変えます。
使用する製品
ゲル・電極バッファー
(ePAGEL HR, EzRun)
電気泳動槽・パワーサプライ
(パジェランAce, MyPower)
機器・試薬・材料
- 細胞・組織サンプル等(例:Hela細胞)
- EzApply/EzLabel FluoroNeo・・・タンパク質抽出・処理液
- e-Pagel HR ・・・プレキャストゲル
- EzRun/EzRun MOPS ・・・電極バッファー
- MyMini BLOCK・・・ヒートブロックインキュベータ
- ラピダス ミニスラブ電気泳動槽/パジェランAce/コンパクトPAGE Ace・・・電気泳動槽
- MyPower・・・パワーサプライ
- EzStain AQua/EzStain Silver/EzStain Reverse・・・ゲル染色液
- トレイ(ゲルサイズより一回り大きいもの)
- シーソーシェーカーatto・・・シーソーシェーカー
自作ゲルを作製する場合
- EzGel Ace/EzGel Stack/EzGel Sep・・・ゲルバッファー
- アクリルアミド/ビス混合液・・・アクリルアミドモノマー
- APS (過硫酸アンモニウム)・・・重合開始剤
- TEMED(N,N,N',N',-テトラメチルエチレンジアミン)・・・重合促進剤
- 蒸留水
- ゲル作製器/多連ゲル作製器
- ゲルプレート
- コウム
- スペーサー
実験方法
サンプル調製
通常の電気泳動サンプル
1.50μLのサンプルに50μLのEzApply (2×濃度、キット添付DTT溶解済みのもの)を加えて混合します。
2.MyMini BLOCKで95℃5分間加熱します(煮沸でもOK)。
3.15,000rpmで5分間遠心し(しなくてもOK)、上清を回収します。
※作製したサンプルは-20℃で保存可能です。
※EzApplyの代わりにSDS Gel Loading Buffer を使用することも可能です。
蛍光ラベル電気泳動サンプル
1.EzLabel FluoroNeoを使用します。40 μLのタンパク質サンプルにキット添付の10 μLのSample buffer (5×濃度) とLabeling reagent を0.5 μL添加して混合します。
2.MyMini BLOCKで95℃3分間加熱します(煮沸でもOK)。
3.2の混合液にReducing agent (DTT)を2μL 添加して混合します。
4.MyMini BLOCKで95℃3分間加熱します(煮沸でもOK)。
※作製したサンプルは-20℃で遮光保存可能です。
参考ページ:組織・細胞からのタンパク質抽出方法、電気泳動用の試料調製もご覧ください。
ゲルの作製
自作ゲルを作製する場合は下記(A)~(D)の試薬が必要です。
(A) アクリルアミド/ビス溶液
アクリルアミド/ビス混合溶液は分画分子量範囲に応じて、一般的に19:1、29:1、37.5:1の架橋率の溶液が使用されます。
架橋率が高い溶液ほど低分子量側の、また架橋率が低いほど高分子量側の分画範囲が広がります。目的分画範囲に応じて下記の例を参考に選択、ご準備ください。
【30(w/v)% アクリルアミド/ビス(29:1)溶液】
29 gのアクリルアミドと 1 gのN,N'-メチレンビス(アクリルアミド) を秤量し、50 mLの蒸留水に溶解します。溶解後、蒸留水で100 mLにメスアップします。
※アクリルアミドのモノマーには神経毒性があります。取扱う場合には手袋など身体の保護を行ってください。
※アクリルアミド/ビス溶液は30(w/v)% アクリルアミド/ビス(29:1)溶液 や30(w/v)% アクリルアミド/ビス(37.5:1)溶液などが市販されています。
架橋率が高い(ビスの割合が多い)と、架橋構造が増えて格子構造が密になった硬いゲルができ、より低分子量領域の分画が明瞭になります。
(B) ゲル緩衝液
EzGel Ace 中性のゲル緩衝液であり、濃縮および分離ゲルに使用できます。作製したゲルは長期冷蔵保存可能(約1か月)です。
EzGel Stack Laemmli法に準拠した濃縮ゲル用緩衝液です。0.5 M Tris-HCl (pH6.8)相当のバッファーです。
EzGel Sep Laemmli法に準拠した分離ゲル用緩衝液です。1.5 M Tris-HCl (pH8.8)相当のバッファーです。
※ゲル緩衝液にはEzGel Ace単独、もしくはEzGel StackとEzGel Sepの組み合わせでご使用ください。
(C) 10% APS (過硫酸アンモニウム)
0.1 gのAPSを秤量し、1 mLの蒸留水に溶解します。
※10% APSは徐々に活性が落ちるため、要時調整することをお勧めします。冷蔵庫で1週間位保存可能です。
(D) TEMED(N,N,N',N'-テトラメチルエチレンジアミン)
原液をそのまま使用します。
参考ページ:ポリアクリルアミドゲルの調製もご覧ください。
主な電気泳動用試薬の組成
電気泳動で使用する主な試薬の組成です。より再現性良く、簡便に実験を行う際はパジェルなどの既製ゲルやアトー試薬をご利用ください。
- サンプルバッファー(5x):250mM Tris-HCl (pH6.8)、8% SDS、0.1% Bromophenol blue、40% Glycerol、100 mM DTT
- 濃縮ゲル緩衝液:0.5 M Tris-HCl (pH6.8)
- 分離ゲル緩衝液:0.5 M Tris-HCl(pH6.8)
- アクリルアミドストック溶液:30%Acrylamide/N,N'-methylene-bis acrylamide (29:1)
- 泳動用緩衝液:25mM Tris, 192mM Glycine, 0.1% SDS
- CBB染色液:0.25% Coomassie Brilliant Blue, 40%メタノール, 7% 酢酸
- 脱色液:40% メタノール、7%酢酸
1.ゲル溶液を調製します。ゲル組成表(下表)に従い、分離ゲルと濃縮ゲルのゲル溶液を作製します。
※APSとTEMED以外の溶液を混合します。
※下表は1枚のミニサイズゲルに必要な容量です。
| 分離ゲル | 濃縮ゲル | ||||
|---|---|---|---|---|---|
| ゲル濃度 | 7.5% | 10% | 12.5% | 15% | 4.5% |
| 蒸留水 | 5mL | 4.2mL | 3.3mL | 2.5mL | 3mL |
| アクリルアミド/ビス溶液 | 2.5mL | 3.3mL | 4.2mL | 5mL | 0.75mL |
| ゲル緩衝液 | 2.5mL | 2.5mL | 2.5mL | 2.5mL | 1.25mL |
| 10% APS | 0.075mL | 0.05mL | 0.05mL | 0.05mL | 0.05mL |
| TEMED | 0.005mL | 0.005mL | 0.005mL | 0.005mL | 0.003mL |
2.分離ゲル溶液にAPSとTEMEDを添加し、泡立てないように混合し、ゲルプレートに分離ゲル溶液を流し込みます。
※泳動槽およびゲル作製器の使用方法は各製造メーカーにお問い合わせください。
3.界面を乱さないように気をつけながら、蒸留水を重層します(0.2~1.0 mL)。
※アクリルアミドは酸素があると重合しにくいため、蒸留水を重層することで空気中の酸素を遮断します。
4.室温で30分以上静置して重合します。
※ゲルの界面が明瞭に見えることを確認してください。重合時間は季節や室温によって変わります。20℃以下では重合しにくくなるので、ご注意ください。
5.重層した蒸留水をペーパータオルなどに吸わせて完全に除きます。
6.濃縮ゲル溶液にAPSとTEMEDを添加して泡立てないように混合し、分離ゲルの上に濃縮ゲルを重層します。
7.コウムを差し込み、室温で30分以上静置して重合します。
※EzGel Aceを使用して作製したゲルは、ラップ等で包み、蒸留水で4倍希釈したEzGel Aceを約5mL(ゲル一枚当たり)入れたハイブリバック等に密閉して冷蔵庫で約一か月保存可能です。
Laemmli法のゲルバッファーで作製したゲルは保存できませんので、即日ご使用ください。
電気泳動
1.泳動槽の下部槽に十分量の電極液を入れます。
※電極液が不足すると泳動パターンが乱れる原因になります。
2. 自作ゲルもしくはe-PAGEL HR(既製ゲル)をパジェランAce(電源付電気泳動装置)に、ゲル下端に空気が入らないように注意しながらセットします。
3.上部槽に十分量の電極液を入れます。
4.1レーンあたり5~10μLのサンプルをアプライします。
※サンプル濃度は精製タンパク質では100ng~1μg/lane、抽出液では1~50μg/laneが適当です。
5.スタートボタンを押して電気泳動を開始します。
※High mode(24W)で35分、もしくはStandard mode (20mA/gel)で約80分間泳動します。
ゲルの染色
1.ミニゲル1枚当たり30~50mL のEzStain AQuaをゲルよりもひと回り大きなタッパーに注ぎます。
2.電気泳動直後のゲルをEzStain AQuaに浸漬し、室温で3時間~一晩振とうしながら染色します。
※高濃度のタンパク質染色には長時間を必要とします。
※電子レンジを使用すると迅速に染色できます。
3.タンパク質バンドが十分染色できたのを確認した後、EzStain AQuaを廃棄し、蒸留水でゲルを軽くすすぎ、新たに十分量の蒸留水を加えて脱色します。
途中、何度か蒸留水を交換し、バックグラウンドが透明になるまで脱色します。
※色素廃液として適切な処理をお願い致します。
※電子レンジを使用すると迅速に脱色ができます。
※自作のCBB染色液(前述)を使用する際は、染色は6時間以上、脱色は専用の脱色液(前述)で4~6時間以上行ってください。
また自作のCBB染色液はEzStain AQuaよりも検出感度が低いため、サンプル量にご注意ください。
参考ページ:銀染色、リバース染色については、電気泳動ゲルのタンパク質の染色もご覧ください。
参考データ
実験例1:染色方法の違い
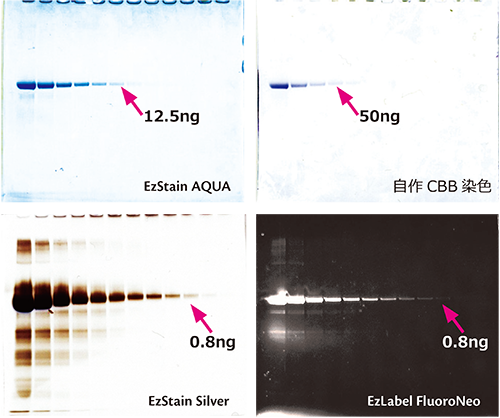
上図はトランスフェリンタンパク質をEzApplyもしくはEzLabel FluoroNeoを使用して電気泳動サンプルを作製した後に、レーン当たり400ngからの1/2希釈系列で泳動した結果です。
電気泳動後のゲルはEzStain AQua、自作CBB染色液、およびEzStain Silverで染色しました。
EzLabel FluoroNeoサンプルは泳動後のゲルをCyanoView (Cyan透過光源)で励起し、540 nm LPフィルターを用いて0.5秒間の露光時間でLuminoGraphにより撮影した結果です。
自作CBB染色液よりもEzStain AQuaは検出感度が高く、またEzLabel FluoroNeoは銀染色と同等以上の検出感度を示しました。
EzLabel FluoroNeoは染色時間が不要であり、撮影後のゲルはウェスタンブロット等の解析にも使用できるため、短時間で効率よく実験を行うのに適しています。
一方、染色後のゲルはウェスタンブロット等への解析には適しません。染色方法は実験目的や検出感度に合わせてを選択してください。
実験例2:泳動バッファーの違い
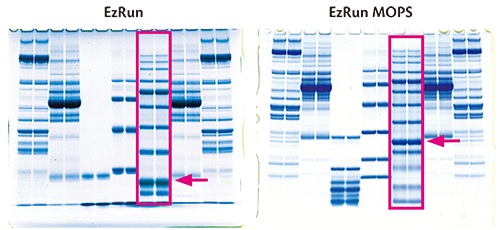
上図は様々なタンパク質を同じアクリルアミド濃度の10% ePagel-HRを使用し、泳動バッファーが異なる条件、EzRun (左)とEzRun MOPS(右)で電気泳動した結果です。
四角で囲った部分は、両方とも分子量マーカーであるEzProtelin Ladderを泳動したレーンですが、EzRun では10本のバンドが検出されたのに対して、EzRun MOPSでは13本のバンドが検出されており、低分子量側のタンパク質も分離できることが示されました。
つまり泳動バッファーをEzRun MOPSに変えるだけで、10%の濃度均一ゲルが、まるで濃度勾配ゲルのようなバンドパターンを示すようになりました。
このように泳動バッファーを変えることで、同じアクリルアミド濃度のゲルを使用しても、タンパク質の分離範囲を変えることができます。
資料ダウンロード
動画で紹介
ミニサイズゲルの作製方法
多連ミニサイズゲル作製器の使用方法
パジェランAceの操作方法